新型鸭细小病毒疫苗研究结果,福建省农业科学院研制的番鸭细小病毒疫苗在哪里...
新型鸭细小病毒疫苗研究结果
福建省农业科学院研制的雏番鸭细小病毒疫苗在哪里...可以用北京国浩高科技的鸭毒康治疗。效果非常好。
哪里可以买到番鸭细小病毒弱毒疫苗
番鸭细小病毒病是由番鸭细小病毒引起的一种传染病(俗称番鸭三周病),其特征是雏番鸭在3周内出现喘息、腹泻、胰腺坏死和出血。其发病率和死亡率可达40%-50%以上。它是目前番鸭养殖业中最严重的传染病之一。 工具/生鸭抗毒临床症状1该疾病的发生尚不清楚,(1)番鸭细小病毒病仅发生在雏番鸭中。因此,有必要在早期加强雏番鸭的饲养管理。如果幼鸭的温度合适,应注意通风,以防止密度过高。刚从蛋壳里出来的年轻番鸭必须避免接触新的蛋以防止感染。 泡妞后及时喝水 番鸭从炕里出来后,必须在4周内被隔离和喂养。番鸭细小病毒病只发生在2-4周龄的番鸭身上,因此被称为“三周颈”。在其他年轻家禽和成年家禽中没有发现疾病。成年番鸭可以被感染,但不会被感染和中毒。 当健康的鸭子和患病的鸭子被聚集在一起或间接喂养被病毒污染的饲料时,它们都可能被感染并生病,从而导致疾病的流行。 消化道感染是主要疾病。番鸭细小病毒病是由番鸭细小病毒引起的番鸭病毒性传染病,只发生在雏番鸭中。由于其发病特点与小鹅瘟非常相似,常与番鸭细小病毒病混淆。 雏番鸭患此病后死亡率较高,对番鸭养殖业危害极大。 番鸭细小病毒病在自然条件下,除番鸭外,其他幼鸟和成年鸟没有发展成玻璃体疾病。各种抗生素和磺胺类药物对番鸭细小病毒病无治疗和预防作用。高免疫血清和高免疫卵黄抗体可用于治疗。 在番鸭细小病毒病流行的地区或受番鸭细小病毒污染的孵化场,在雏番鸭离开炕后立即皮下注射高免疫血清或卵黄抗体,可以预防和控制疾病的流行和发生。 高,
福建省农业科学院研制的番鸭细小病毒疫苗在哪里...
福建省农业科学院研制的雏番鸭细小病毒疫苗在哪里...可以用北京国浩高科技的鸭毒康治疗。效果非常好。

哪里可以买到番鸭细小病毒弱毒疫苗
新型鸭细小病毒疫苗研究结果范文
本文的目录导航:
[标题]鸭细小病毒灭活疫苗的研制
[1.1-1.7]鸭细小病毒灭活疫苗研制简介
[1.8-1.11]细小病毒病原体诊断方法和病毒疫苗研制材料及方法
[第二章]新型鸭细小病毒疫苗的研究成果
[第四章-参考文献]鸭细小病毒灭活疫苗研制的讨论与结论
3结果
3.1鸭细小病毒最佳感染途径的确定
3.1.1不同感染途径对雏鸭体重的影响
在感染三组雏鸭7 d、14 d、21 d后,对三组雏鸭测量体重,记录数据。结果表明,在接种病毒后7 d,三组雏鸭体重并无明显差异,在感染后14 d,口服组动物平均体重极显着低于对照组,肌注组低于对照组,并不显着。在接种病毒后21 d,口服组雏鸭体重极显着低于对照组,肌注组低于对照组,并不显着。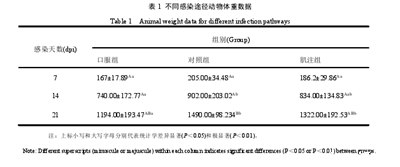

3.1.2不同攻毒途径对雏鸭喙长的影响
在感染三组雏鸭7 d、14 d、21 d后,对三组雏鸭测量喙长长度,记录数据。结果表明,接种病毒后7d,口服组极显着低于对照组,肌注组显着低于对照组。接种病毒后14 d,口服组极显着低于对照组,肌注组显着低于对照组。接种病毒后21 d,口服组极显着低于对照组,肌注组显着低于对照组。由上述数据可以看出口服组效果比肌注组更好,因此,可以确定用口服病毒这一途径感染雏鸭。
3.2鸭细小病毒F10~F40代病毒致病性
3.2.1 F10~F40代病毒对雏鸭体重的影响
在攻毒当天,四组感染病毒组之间和对照组并无明显差异。在攻毒后14 d,F10代攻毒组体重极显着低于对照组,F20和F30显着低于对照组,F40组和对照组体重差异不显着;在攻毒21d后,F10极显着低于对照组,F20和F30病毒组显着低于对照组,而F40和对照组动物体重差异不显着。
3.2.2 F10~F40代病毒对雏鸭喙长的影响
分别在感染病毒后7、14、21 d测量五组雏鸭的鸭喙长度,结果如表所示,在攻毒后7 d,F10和F20组雏鸭喙的长度显着低于空白对照组,F30和F40和对照组差异不显着。在攻毒后14 d,F10组雏鸭的喙长显着低于对照组,F20和F30雏鸭喙长显着低于对照组,F40和对照组差异不显着。在攻毒后21d,F10和F20显着低于对照组,F30显着低于对照组,F40组喙长和对照组差异不显着。
3.2.3 F10~F40代病毒接种动物排毒情况
分别在攻毒后3 d、5 d、7 d、14 d、21 d采集五组雏鸭肛拭子,应用PCR检测棉拭子中的鸭细小病毒核酸,结果如表所示,在感染病毒后3 d,空白对照组并没有检测到鸭细小病毒核酸,F10、F20和F30代病毒组均检测到4个阳性、1个阴性。
F40代病毒组检测到3个阳性、2个阴性。病毒感染后5-21 d,空白对照组均为检测到鸭细小病毒,病毒感染后5~21 d,F10~F40病毒组肛拭子全部检测阳性。 3.3新型鸭细小病毒疫苗检测结果
3.3新型鸭细小病毒疫苗检测结果
3.3.1鸭胚病变接种
SD鸭细小病毒毒株后,鸭胚尿囊液粘稠,似果冻样,尿囊膜变厚。 3.3.2病毒的PCR检测
3.3.2病毒的PCR检测
将培养144 h接种病毒后的鸭鸭胚取出的尿囊液。提取尿囊液中病毒的基因组。用实验室设计的引物,对基因组进行PCR检测,用上述的PCR程序对上面提取基因组进行PCR.将扩增好的基因组用电泳仪进行电泳。扩增出659 bp的条带。
3.3.3种毒的纯净性检测
对新型鸭细小病毒做疫苗用种毒进行检测,未见到有霉菌、细菌污染。将疫苗用种毒接种硫乙醇酸盐培养基(T.G)、葡萄糖蛋白胨培养基(G.P)在1~5 d内观察种毒组和对照组并没有霉菌和细菌生长。对照组的两种培养基没有霉菌、细菌生长,证明两种培养基没有污染,疫苗用种毒组的两种培养基没有霉菌生长。
3.3.4疫苗用种毒的外源病毒检测
根据本实验室已经完善的PCR反应条件,对新型鸭细小病毒疫苗用种毒的基因组进行体外扩增进行扩增,通过用1%的琼脂糖凝胶电泳对呼肠孤病毒(801 bp)、禽流感病毒(428 bp)、鸭肝炎病毒(176 bp)、鸭病毒性肠炎(691 bp)、新型鸭细小病毒(659 bp)进行检测,只有新型鸭细小病毒显示阳性,其余检测结果呈阴性。
3.3.5疫苗用种毒毒力的测定
疫苗用种毒的鸭胚半数感染量(EID50)的测定,将该毒接种鸭胚,因为该病毒对鸭胚没有致死能力,所以将鸭胚培养144 h后,收取尿囊液后进行PCR检测,统计不同梯度病毒接种量的检测结果,实验结果用Reed和Muench方法计算该病毒的鸭胚半数感染量(EID50),该疫苗用毒株的结果为10-4.5/0.2 m L.
3.3.6灭活油乳剂疫苗检验
3.3.6.1剂型的检验
取一干净平皿盛满清水,将制作好的疫苗滴一滴在平皿中,油乳剂疫苗漂浮在水面上,第一滴均匀分散在水面,第二滴疫苗则不会散开,轻轻晃动平皿并未散开,证明疫苗是油包水型。
3.3.6.2疫苗稳定型检验
取10 m L制作完成的油乳剂疫苗于离心管中,3000 r/min离心15 min,并没有出现分层破乳的情况,证实该疫苗的稳定型良好。
3.3.6.3疫苗无菌检验
将研制好的成品疫苗接种0.1 m L于培养基中,无细菌及霉菌等微生物生长,则表明该疫苗的无菌检验合格。
3.3.6.4疫苗粘度检验
在常温的条件下,用内径1.2 mm的毛细吸管吸取1 m L研制的成品疫苗,三次保持垂直放出0.4 m L疫苗的平均时间为4.8 s.符合油乳剂灭活疫苗的要求(2~8 s)。
3.3.6.5疫苗的安全性检验
实验组雏鸭注射成品的油乳剂灭活剂疫苗,观察雏鸭的精神状态良好,生长发育正常,并未出现短喙长舌、瘫痪等症状。从外观注射部位也没有出现红肿和组织坏死等炎性反应。对照组也全部正常,并未出现不良反应。
3.3.6.6最小免疫剂量
在雏鸭1日龄用灭活疫苗对4组雏鸭进行不同剂量的免疫,对照组不免疫。在免疫后7 d,对5组雏鸭进行攻毒。采集4组疫苗组和对照组雏鸭排毒、体重、喙长数据进行分析。得出免疫100 μL~1000 μL疫苗可以对雏鸭进行保护。而对照组雏鸭没有疫苗保护,症状明显。
3.3.6.6.1疫苗组和对照组排毒
对1日龄的小鸭子进行不同剂量的免疫,分别免疫100 μL、250 μL、500 μL、1000 μL的剂量。免疫7 d以后对雏鸭进行攻毒,每只鸭子攻毒1 m L的SD毒株的病毒。攻毒后的3、5、7、14、21 d采集各组雏鸭的肛门棉拭子,加入0.8 m L的生理盐水中。用PCR鉴定检查是否有排毒出现,对照组从攻毒后5 d就100%(10/10)检测到排毒出现,直至攻毒后21 d仍然可以持续的100%检测到排毒出现。但是100~1000 μL免疫组,从攻毒后3 d采集棉拭子中并未检测到病毒核酸,直至21 d也并没有检测的病毒。
3.3.6.6.2对照组和疫苗组
体重攻毒后的第一天,雏鸭的初体重并没有明显的差异。有数据可以看出在攻毒后7、14、21 d对照组与疫苗组体重数据对比,对照组体重极显着低于疫苗组(P≤0.01)。同时,100~1000 μL四组免疫组之间的体重对比差异不显着(P≥0.05)。说明四组免疫组都可以保护雏鸭不受新型鸭细小病毒的攻击。
3.3.6.6.3对照组和疫苗组
喙长攻毒第5 d后,对5组的雏鸭的喙长进行了测量,将数据用SPSS软件进行统计。将对照组和疫苗免疫组的数据进行了对比,统计结果显示100~1000 μL疫苗免疫组四组之间并没有明显的差异(P≥0.05),而对照组雏鸭的喙长和四组免疫组雏鸭的喙长差异极显着(P≤0.01)。 3.3.6.6.4对照组和疫苗组喙宽
3.3.6.6.4对照组和疫苗组喙宽
攻毒第5 d后,对5组的雏鸭的喙长进行了测量,将对照组和疫苗免疫组的数据进行了对比,统计结果显示100~1000 μL疫苗免疫组四组之间并没有明显的差异(P≥0.05),而对照组雏鸭的喙长和四组免疫组雏鸭的喙长差异极显着(P≤0.01)。由上述数据可以证明几个不同浓度剂量的疫苗都抵御住了病毒的攻击,由于免疫50 μL在实际生产实践过程中有很大的操作难度,因此不对疫苗的50μL剂量进行攻毒保护实验,所以确定该疫苗的最细小免疫剂量为100μL.
3.3.6.7.4对照组病鸭病理切片
肝脏:局部视野可见炎性细胞呈灶性浸润;肝细胞不同程度肿胀、变性、坏死(12-1),肾脏:肾小管上皮细胞肿胀、坏死,肾小管管腔狭小或闭锁,间质血管充血、出血(12-2)。间质可见少许炎性细胞浸润和血管充血。心脏:局部视野可见心肌纤维出现肿胀、坏死,间质轻度充血(12-3)。胰腺:局部视野可见腺泡坏死(12-4)。小肠:小肠上皮轻度脱落,固有层炎性细胞浸润(12-5)。
