细胞自噬和凋亡机制综述,凋亡、坏死和自噬的比较?
细胞自噬和凋亡机制综述
凋亡、坏死和自噬的比较?从形态学上看,细胞凋亡会导致染色体固结、染色加深、细胞膜内陷形成凋亡小体,最终导致细胞解体。坏死似乎是细胞的直接裂解(我对此了解不多);自噬是一种自噬泡,它形成双层膜,包裹细胞质中的物质,然后与溶酶体融合以消化内含物。生理意义:细胞凋亡是细胞死亡的正常方式
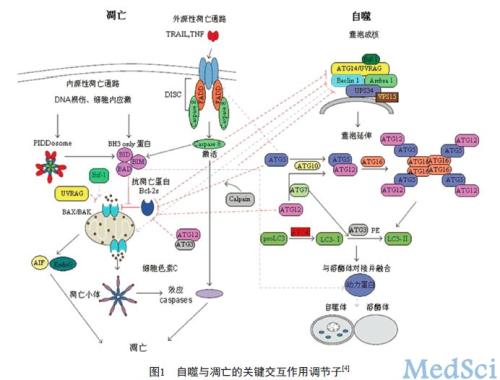
请问凋亡与自噬的区别
从形态学上看,细胞凋亡会导致染色体固结、染色加深、细胞膜内陷形成凋亡小体,最终导致细胞解体。自噬是一种自噬泡,它形成双层膜,将物质包裹在细胞质中,然后与溶酶体融合以消化内含物。 生理上,凋亡是细胞死亡的正常方式。细胞凋亡后,细胞必须死亡。自噬只存在于细胞中。自噬和凋亡对细胞有不同的意义。凋亡是细胞的程序性死亡。细胞的自然更新和被病原体感染的细胞的去除是通过细胞凋亡来完成的。然而,自噬是将受损、变性和衰老的蛋白质或细胞器运输到溶酶体并降解它们的过程。a错了。根据图a,细胞自噬的凋亡是由具有相同意义的细胞凋亡、程序性细胞死亡、细胞自我更新、病原体感染的细胞清除和细胞凋亡引起的。细胞自噬运输到溶酶体和降解过程中受损、变性和腐烂的蛋白质或细胞器是错误的。根据该图可知,细胞的自噬过程反映溶酶体的消化和营养功能。细胞自噬:荧光显微镜下观察:凋亡细胞体积缩小,呈现核浓缩,沿核膜呈点状、新月形或棒状。显微镜下可以看到四种细胞形态:活细胞,核染色质呈绿色,结构正常;在早期凋亡细胞中,核染色质呈绿色但浓缩。具有橙色染色质和正常结构的非凋亡死细胞;在晚期,自噬和凋亡对细胞有不同的意义。凋亡是细胞的程序性死亡。细胞的自然更新和被病原体感染的细胞的去除是通过细胞凋亡来完成的。然而,自噬是将受损、变性和衰老的蛋白质或细胞器运输到溶酶体并降解它们的过程。a错了。b .如图所示,
凋亡、坏死和自噬的比较?
凋亡、坏死和自噬的比较?从形态学上看,细胞凋亡会导致染色体固结、染色加深、细胞膜内陷形成凋亡小体,最终导致细胞解体。坏死似乎是细胞的直接裂解(我对此了解不多);自噬是一种自噬泡,它形成双层膜,包裹细胞质中的物质,然后与溶酶体融合以消化内含物。生理意义:细胞凋亡是细胞死亡的正常方式

请问凋亡与自噬的区别
细胞自噬和凋亡机制综述范文

细胞自噬是进化上保守的降解胞内受损的细胞器、异常蛋白质、外源微生物的溶酶体依赖代谢途径[1].目前研究较多的为巨自噬(即自噬)目前,已被广泛认可的自噬调节因子包括:腺苷酸活化蛋白激酶(AMPK)/雷帕霉素靶(mTOR)、p62和自噬阳性调节蛋白(Beclin1) [5-6]。凋亡是由基因及其编码核糖核酸控制的程序性细胞死亡(PCD型),可由外源途径(死亡受体Fas或TRAIL途径)介导。其典型的形态学特征是核浓缩和凋亡小体(7)。诱导细胞产生第一型多囊卵巢综合征(PCD)可以抑制肿瘤生长、增殖和迁移,为癌症治疗提供重要思路。目前,细胞凋亡的机制已被明确研究,许多关键调控因子(包括磷酸酯酶(FAP)-1、p53、Bcl2等。)已经被发现。研究表明,虽然自噬和凋亡在形态特征上有显著差异,但两者之间也存在相关性,如在关键细胞反应和特定因素的调控下发生转化。因此,研究自噬与细胞凋亡的相关性及其调控机制在肿瘤治疗中具有重要意义。本文综述了自噬和凋亡相关调控机制的最新研究进展。,并以在电镜下出现大量双层膜结构的自噬体为其形态学特征1自噬相关调节机制.适度的自噬可促进细胞生存,但过度自噬可致细胞自噬性死亡[2](II型PCD(程序化细胞死亡)),因此诱导细胞II型PCD可作为治疗凋亡耐受性肿瘤的一个新思路,而II型PCD的确切机制研究才刚刚起步。
[3]
[4]
1.1毫托调节细胞自噬
mTOR作为一种综合的生长因子和营养信号,是平衡细胞生长和自噬途径的重要调节剂,在应对细胞内各种生理反应和外部环境压力中发挥作用。作为一种营养传感器,mTOR在缺乏营养的情况下被抑制,这是诱导细胞自噬的关键步骤1.2二类五氯苯酚调节机制。mTOR可以通过调节自噬相关蛋白(Atg)来影响自噬。Atg1可能是最初在自噬诱导的初始阶段起作用的蛋白质,例如在膜结构形成的早期事件和形成前的自噬囊泡结构中。Atg13能降低Atg1与其结合蛋白的亲和力,抑制自噬。Atg13和17与1的组合可以在雷帕霉素或营养缺乏的诱导下增强Atg1激酶活性,这在形成自噬结构[8]中起重要作用。因此,Atg复合物在mTOR引起的自噬途径中发挥重要作用。哺乳动物自噬相关蛋白(ULK1-4)与Atg有一定同源性。ULK1和ulk2灭活激酶突变体的过表达导致自噬的抑制。当mTOR被抑制时,诱导的自噬将导致Atg13磷酸化,并增强ULK1和ULK 2激酶的活性。因此,Atg和uLK是mTOR的直接效应器。mTORC1活性的增强降低ULK1活性,从而抑制自噬。MTORC1还可以通过改变其在细胞[8]中的位置来调节ULK效应。
此外,AMPK、mTOR和ULK1在不同环境中的竞争性磷酸化反应可以调节ULK1激酶的活性,从而影响自噬过程与普遍接受的自噬是细胞保护机制的观点相反,过度和持续的自噬会导致细胞死亡,另一种公认的诱导自噬的多肽化合物(Tat-vFLIPα2)可以通过释放Atg3 [13诱导相同的ⅱ型PCD。一般来说,二型五氯苯酚使用特定的死亡机制和形式来启动和完成细胞死亡过程,但目前还没有有效和可靠的生化标准来定义这种死亡模式2.1色素上皮衍生因子(PEDF)通过调节p53和Fas-1/Fas途径诱导细胞凋亡。。为了区分伴随自噬的死亡模式,这种自噬诱导的死亡模式被称为ⅱ型PCD,其形态变化是自噬空囊泡的形成,但这种现象也可以在凋亡和坏死细胞下看到。证据表明,自噬相关基因在促进死亡方面有很大作用。这种死亡方式也见于缺乏完整凋亡途径的无脊椎动物。在具有完全凋亡途径的真核细胞中,高度自噬可导致细胞死亡而不发生凋亡。。ULK作为AMPK的直接底物,在缺乏营养的情况下通过磷酸化ULK1的Ser317和777位点诱导自噬。相反,在足够的营养下,高活性mTOR通过磷酸化ULK1的Ser757位点抑制ULK1活性,从而破坏AMPK和ULK的结合以抑制自噬用人类免疫缺陷病毒衍生的转导蛋白(Tat)和Beclin 1进行的实验表明,它可以通过阻断Beclin1/高尔基复合体相关蛋白(GAPR-1)复合体的结合诱导高度自噬,并且细胞死亡是浓度-时间依赖性的。SiRNA Becrin1或Atg13或14可减少自噬,也可被3-自噬抑制剂(MA)阻断,但不会受到凋亡和坏死相关因子的影响。它也有其独特的形态特征:内质网肿胀分裂、细胞基质粘附、肿胀核周围核仁中心凹陷结构、颗粒物质聚集。这种死亡模式依赖于细胞内钠离子、钾离子三磷酸腺苷酶(离子泵消耗细胞内20%三磷酸腺苷)的调节,并在自噬诱导肽、饥饿和缺血缺氧2凋亡相关调节机制的诱导下出现,其可被钠离子、钾离子三磷酸腺苷酶拮抗剂和敲除钠离子、钾离子三磷酸腺苷酶基因的手段阻断。钠离子、钾离子三磷酸腺苷酶介导的ⅱ型PCD与地高辛处理的细胞具有相同的机制:既不通过凋亡和坏死途径,也没有传统自噬的后期阶段;但第二型五氯苯酚[12]。。
[8]
[9]
[10]
[11]
[12]
[13]
PEDF是一种具有抗肿瘤作用的强效抗血管生成剂。因为它能作用于各种类型的肿瘤,研究人员对此很感兴趣。Fas属于肿瘤坏死因子受体家族,参与最重要的外部凋亡途径。然而,Fas-L/Fas信号通路缺陷经常在肿瘤中发现,这被认为是肿瘤细胞从免疫系统逃逸的机制。因此,提高细胞表面Fas水平可能是修复Fas-1/Fas死亡信号通路和恢复肿瘤细胞正常凋亡能力的关键步骤。
研究表明,野生型p53可以通过激活Fas基因增加细胞表面Fas,修复Fas-1/Fas死亡信号通路,促进Fas缺陷细胞凋亡,[14]。PEDF可以上调p53的表达,敲低p53减弱PEDF介导的Fas上调。研究证明,PEDF可以通过修复Fas-1/Fas信号通路[14]显著诱导A549和Calu-3细胞凋亡。机制:①PEDF在p53的介导下增强Fas-1的表达,并使Fas以p53和FAP-1依赖的方式转移至细胞膜,从而增加两种细胞死亡途径的敏感性。(2) ②PEDF能显著激活caspase-8/9,提高PARP片段水平,直接诱导细胞凋亡。半胱天冬酶-8同时激活可以激活Fas-1/Fas介导的细胞凋亡。③FAP-1基因敲除作为Fas转移的负调控因子,促进Fas在细胞表面的表达。FAP-1的潜在结合位点是p53。其过表达和激活抑制FAP-1的表达并消除FAP-1的影响。研究证明,PEDF也可以通过其他方式促进细胞凋亡[15-16]。总之,这些发现揭示了PEDF诱导肿瘤细胞凋亡的新机制,为抗Fas肿瘤的治疗提供了思路。
2.2 FAP-1通过调节Fas抑制细胞凋亡
在肿瘤细胞中,Fas表达减少,转运损伤和FAP-1过表达都降低了细胞对Fas诱导的凋亡的敏感性,使其逃避免疫监测(17)。FAP-1可以减弱Fas死亡信号。
其作用机制是FaP-1通过切断Fas从高尔基体到细胞表面的转运而停止细胞质中的Fas,或者FAP-1通过增加Fas从细胞表面到细胞质的转运而削弱细胞表面受体FA的功能。共定位实验表明,FAP-1参与了Fas的调控,细胞内Fas的变化与FAP-1的表达一致,但细胞表面的Fas浓度与FAP-1[18’的表达趋势相反,只有一小部分FAP-1能够抑制Fas的转运。然而,它不影响Fas的稳定性和信号转导,FAP-1功能可能由于Fas-C末端的突变和转运的积累而丧失。因此,FAP-1和Fas之间的平衡在决定细胞命运中起着重要作用。FAP-1在触发Fas介导的细胞凋亡中起重要作用,并指导细胞凋亡的初级级联反应。
3自噬与凋亡的相互调节
3.1自噬通过FAP-1的降解调节细胞凋亡
以前的观点认为抑制自噬诱导细胞凋亡。最近,有一种理论认为细胞凋亡也可以由自噬引起,因为自噬引起的FAP-1的降解使细胞容易死于Fas诱导的细胞凋亡[19]。即使在最佳生长条件下,细胞间的自噬流动也存在差异,这可能是由自噬[19]关键调节因子水平或活性的瞬时变化引起的。然而,实验发现高和低自噬细胞是通过流动技术分离的。自噬程度高时Fas诱导凋亡的敏感性大于介导凋亡的死亡受体(TRAIL),而自噬程度高的细胞对Fas诱导凋亡的敏感性大于自噬程度低的细胞,TRAIL无差异[20],表明自噬可以在不同的死亡受体应激和不同的自噬程度下影响凋亡。在ⅰ型细胞中,饥饿刺激的自噬促进Fas诱导的凋亡,通过化学药物或基因敲除抑制自噬,降低对Fas和Fas诱导的凋亡的敏感性,而自噬抑制ⅱ型细胞的凋亡。表明不同细胞类型的自噬对细胞凋亡有不同的影响,[20]。FAP-1在自噬调节Fas诱导的凋亡中是必需的:FAP-1通过选择性降解自噬配体p62来调节自噬,p62直接招募FAP-1一起降解自噬泡来调节Fas诱导的凋亡,p62-FAP-1的相互作用依赖于Fas-1[20]。
因此,不同的细胞系和同一细胞系中不同水平的自噬瞬时差异可以决定细胞凋亡的过程。此外,自噬调节凋亡的方向也取决于其刺激类型,即死亡受体类型。
3.2 p53在调节自噬和凋亡中的作用
P53在调节自噬和凋亡中起着重要作用:① p53激活细胞核中的AMPK抑制mTOR,反式激活自噬损伤调节因子诱导自噬,然后通过动态随机存储器在基因毒性压力反应下引导细胞凋亡死亡。②p53可通过激活Bax、PUMA、Bid或降低Bcl-2的表达诱导细胞凋亡。然而,细胞质中的p53可以抑制自噬并促进凋亡,[21]。因此,p53和FAP-1之间可能有某种联系。P53可以调节FAP-1基因的转录,也可以抑制其转录[22]。p62在FAP-1和自噬[23]之间起重要作用,因此推测p53与p62具有相似的作用或p53参与p62-FAP-1的相互作用是合理的。
自噬和凋亡是真核生物的重要生理现象,与各种生理活动和疾病,尤其是癌症密切相关。它们是由多个信号通路和多个关键信号分子共同调节的复杂过程,可以决定细胞的存活和死亡。自噬与细胞凋亡有三种可能的关系[24]:①自噬与细胞凋亡的协同关系。它们通过合作完成死亡过程,在细胞死亡过程中互补不足;②自噬拮抗细胞凋亡。自噬可以调节相关凋亡蛋白,使细胞存活。③自噬促进细胞凋亡。自噬通过维持细胞内必需的三磷酸腺苷水平诱导细胞凋亡。随着生物医学和科学技术的发展,这些问题将会有进一步的突破。阐明自噬、凋亡和肿瘤细胞代谢之间的途径机制,可以为靶向治疗提供理论依据,为癌症治疗带来新的希望。
参考:
[1]张毛娜、唐志杰、陈力。自噬-凋亡途径在肿瘤靶向治疗中的意义[。肿瘤学杂志,2014,5 (20): 413-418。
[2]陈宋风,邵吴增。引用该论文[。国际骨学杂志,2013,4 (34): 269-280。
[3]翟海城,宋晋宁。自噬相关蛋白在自噬和凋亡中的作用及研究进展[。中国脑部疾病与康复杂志,2013,5 (3): 42-46。
[4]吴静,赵勇,石长宏,等.自噬的形态特征和分子调控[.现代生物医学进展,2010,10 (10): 3941-3944。
[[5]张永兵,龚建升,邢泰英,等.自噬蛋白p62/SQSTM1通过调节U87MG细胞凋亡参与哈姆雷特诱导的细胞死亡[]。细胞死亡与疾病,2013,4:e550。
[6]陈兰芳,梁肖。自噬的分子机制和功能[。实验和实验室医学,2014,2 (32): 157-163。
[7]董琳,童羽。Bcl-2蛋白对自噬和凋亡的调节及其相关机制[。医学研究杂志,2012,8 (41): 174-177。
[8]荣春海,罗世海,曹军,等.嗜食性[的分子调控]。《FEBS快报》,2010,584(7):1287-1295。



