缺氧诱导因子-1㬱与相关疾病的研究综述,缺氧诱导因子的本质
缺氧诱导因子-1㬱与相关疾病的研究综述
缺氧诱导因子的必需缺氧诱导因子-1是一种具有转录活性的核蛋白,具有广泛的靶基因,包括近100个与缺氧适应、炎症发展和肿瘤生长相关的靶基因[3,4]。当它与目标基因结合时,身体通过转录和转录后调节产生一系列反应。虽然有些反应具有适应性代偿特性,但它们通常会给身体带来病理。
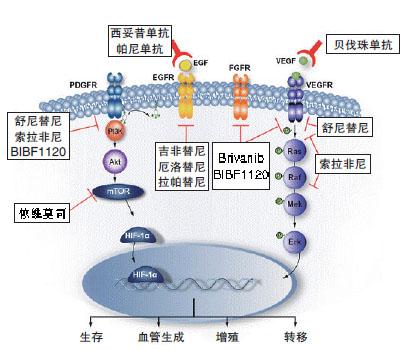
缺氧诱导因子的HIF-1生物学活性的分子基础
缺氧诱导因子-1是一种异二聚体,主要由120kD缺氧诱导因子-1α和91~94kD缺氧诱导因子-1β亚基组成 缺氧诱导因子-1β亚单位也被称为芳香烃受体核转运体(ARNT)。该基因位于人类染色体1的q21区域,在细胞中稳定表达,并起结构作用。缺氧诱导因子-1α组,缺氧诱导因子-1,即缺氧诱导因子-1 (HIF-1),于1992年由塞门扎和王首次发现。随后,建立了缺氧诱导因子-1的结构,并证明了其cDNA的编码序列。 缺氧诱导因子-1通常在人类和哺乳动物细胞中发现,并在正常氧气(21%O2)下表达。然而,合成的缺氧诱导因子-1蛋白非常高。大多数在缺氧条件下需要氧气呼吸的物种具有保守序列HIF-1。 其转录有严格的调控机制。 缺氧诱导因子-1是由α亚基和β亚基组成的异源蛋白质二聚体,β亚基是芳香烃受体核易位(ARNT) 缺氧诱导因子-1属于基本螺旋-环-螺旋家族中的每-ARNT-辛。我建议输入关键词,如非特异性抗氧化剂,临床试验在谷歌的人体试验中失败,然后从结果中选择文章。谷歌的全文搜索能力更好。我只想到这个方法。缺氧诱导因子-1α (HIF-1α)作为唯一在特定缺氧条件下有活性的转录因子,在肿瘤细胞侵袭和转移中起着重要作用,[3] 波形蛋白是上皮-间质转化的标志分子,同时,
缺氧诱导因子的本质
缺氧诱导因子的必需缺氧诱导因子-1是一种具有转录活性的核蛋白,具有广泛的靶基因,包括近100个与缺氧适应、炎症发展和肿瘤生长相关的靶基因[3,4]。当它与目标基因结合时,身体通过转录和转录后调节产生一系列反应。虽然有些反应具有适应性代偿特性,但它们通常会给身体带来病理。

缺氧诱导因子的HIF-1生物学活性的分子基础
缺氧诱导因子-1㬱与相关疾病的研究综述范文
缺氧诱导因子-1α (HIF-1α)在缺氧缺血性脑损伤、缺氧性肺病、缺氧缺血性心肌疾病、肿瘤和炎症中的作用越来越受到学术界的关注,并由此产生了许多新的观点和认识。有些观点和理解仍然不同。本文对此做了简要总结。
1缺氧诱导因子-1α与缺血缺氧性脑损伤
学者们对缺氧缺血性脑损伤中缺氧诱导因子-1α的作用有不同的看法。大多数学者认为缺氧诱导因子-1α具有抗凋亡、保护脑神经和促进脑血管形成的作用。Ogunshula [1]等人报道,缺氧诱导因子-1α可通过增强抗凋亡作用,促进氧化应激和局部脑缺血后神经元的存活。王[2]等研究发现,适度运动预处理可通过上调缺氧诱导因子-1α的表达,减少缺血再灌注引起的局灶性脑梗死面积。在对神经母细胞瘤细胞凋亡的研究中,发现缺氧缺血小鼠模型中缺氧诱导因子-1α和存活素的表达水平显著升高,进而发挥抗细胞凋亡的作用,[3]。至于缺氧诱导因子-1α(HIF-1α)发挥上述抗凋亡和保护脑细胞的机制,朱然而,其他研究者持相反的观点,认为缺氧诱导因子-1α可导致神经细胞凋亡和坏死,并参与脑缺血缺氧后的炎症反应。闵2缺氧诱导因子-1α与缺氧性肺病和其他研究报道,缺氧诱导因子-1α抑制剂牡荆素对急性和慢性新生儿脑损伤具有神经保护作用。程2.1缺氧诱导因子-1α与慢性阻塞性肺疾病等研究表明,缺氧诱导因子-1α抑制剂能保护培养液中的皮质细胞免受缺血性应激,减少缺血性卒中大鼠模型的神经元细胞坏死。据信缺氧诱导因子-1α可促进神经元坏死。关于缺氧诱导因子-1α促进细胞坏死的可能机制,辛格·在慢性阻塞性肺疾病的发病机制中,缺氧诱导因子-1α的作用越来越受到重视。然而,学术界对缺氧诱导因子-1α在慢性阻塞性肺疾病发病机制中的病理生理机制和作用有不同的看法。一些学者认为,缺氧诱导因子-1α在慢性阻塞性肺疾病患者肺组织中的表达上调,陶然而,其他研究人员持有相反的观点。据报道,缺氧诱导因子-1α在慢性阻塞性肺疾病患者肺组织中的表达降低,p53的表达增加,大量实验结果表明,缺氧诱导因子-1α在人乳头状瘤的形成中起着至关重要的作用。周缺血性心肌疾病是目前威胁人类健康的主要疾病。研究表明缺氧诱导因子-1α在调节心肌保护中发挥重要作用。基利安·4.1缺氧诱导因子-1α与血管生成和肿瘤转移等将缺氧诱导因子-1α腺病毒载体导入心肌细胞,稳定、大量表达缺氧诱导因子-1α。通过上调多种在促进血管生成中发挥作用的细胞因子,内源性内皮祖细胞在缺血心肌中大量积累,从而建立心脏的侧支循环并改善心脏功能。严先轸缺氧诱导因子-1α的激活在促进肿瘤血管生成中起着关键作用。缺氧诱导因子-1α通过上调血管内皮生长因子的表达,促进肿瘤血管生成,导致肿瘤侵袭和淋巴结转移。研究发现缺氧诱导因子-1α抑制剂能显著降低肿瘤生长、血管生成和转移缺氧诱导因子-1α调节肿瘤细胞凋亡的确切机制仍不清楚。对于上述两种相反的观点,作者认为缺氧诱导因子-1α由于缺氧程度和时间的不同,在缺氧组织的凋亡中起着双重作用,既能起到抗凋亡作用,又能起到促凋亡作用。此外,缺氧还可以通过非缺氧诱导因子-1α途径调节细胞凋亡,因此缺氧诱导因子-1α对肿瘤细胞凋亡具有不同的调节作用。进一步探索缺氧诱导因子-1α参与肿瘤细胞凋亡的特异性信号通路,将为临床抗肿瘤提供新的思路和手段。。最近的一项研究发现,乳腺癌合并糖尿病患者乳腺癌组织中的缺氧诱导因子-1α和血管内皮生长因子显著增加,提示缺氧诱导因子-1α通过其靶基因血管内皮生长因子5缺氧诱导因子-1α和炎症增强肿瘤组织中的血管生成。在一份结直肠癌研究报告中,缺氧诱导因子-1α参与肿瘤血管生成、转移、细胞存活和化疗耐药性微环境缺氧是炎症组织的重要病理特征。缺氧损伤通常伴有炎性细胞浸润,炎性反应往往导致细胞缺氧反应途径的激活。最近的研究发现缺氧诱导因子-1α可以调节炎症。目前,已知炎症因子如白细胞介素-6、生长因子-1、白细胞介素-1β、肿瘤坏死因子-α、前列腺素E2和脂多糖可以激活缺氧诱导因子-1α的转录活性。此外,缺氧诱导因子-1α不仅调节巨噬细胞的免疫相关基因,还调节CD4+和CD8+T细胞介导的炎性细胞因子的产生。。等人发现,老年冠心病患者缺氧诱导因子-1α和血红素氧合酶-1的表达水平随着心肌缺血程度的增加而增加。缺氧诱导因子-1α通过调节其下游靶基因HO-1及其反应产物来提高心肌对缺血缺氧的耐受性,从而在保护机体方面发挥重要作用。最近的一项研究证实,在大鼠心肌缺血模型中,注射缺氧诱导因子-1α腺病毒载体的大鼠心肌梗死面积小于对照组侵袭和转移是恶性肿瘤发展的重要特征,可以发生在肿瘤发展的任何阶段。缺氧诱导因子-1α在肿瘤侵袭和转移中起着至关重要的作用。肿瘤缺氧时,各种黏附分子、表面分子、膜蛋白和外源蛋白在缺氧诱导因子-1α的调控下参与肿瘤转移。魏学者们对缺氧诱导因子-1α在炎症中的作用有不同的看法。大多数研究认为缺氧诱导因子-1α促进炎症反应。最近的一项研究表明,缺氧诱导因子-1α能增强用舒林达[5]雷赛勒,李莉,沃金肖,等.通过FG- 4497抑制缺氧诱导脯氨酰-4-羟化酶减少缺血性卒中期间的脑组织损伤和水肿形成[.公共科学图书馆1,2014,9( 1) : e84767。治疗的小鼠近端结肠的炎症反应。胡[6]闵JW,胡JJ,何敏,等。牡荆素通过抑制缺氧缺血性脑损伤新生鼠模型缺氧诱导因子-1α链减少缺氧缺血性脑损伤[。神经药理学,2015,99: 38-50。等人发现缺氧诱导因子-1α与Toll样受体协同促进类风湿性关节炎的炎症活动。苏雷什·[7]程YL,朴建生,曼萨内罗,等.缺氧诱导因子- 1α和凹口- 1结合促进缺血性卒中神经细胞死亡的证据[.神经iol Dis,2014,62: 286-295。和其他研究表明,2型肺泡上皮细胞中缺氧诱导因子-1α的激活是肺挫伤后急性炎症的主要驱动力。等报道,在抑制缺氧诱导因子-1α的表达后,胰腺癌细胞的侵袭性、抗缺氧能力和扩散能力下降。其机制可能是缺氧诱导因子-1α通过上调小窝蛋白-1促进配体-表皮生长因子受体的信号转导,增加肿瘤细胞的增殖、迁移和侵袭能力菲茨帕特里克·[8]辛格N,夏尔马G,米沙拉诉缺氧诱导因子-1:其在脑缺血中的潜在作用[J]。细胞摩尔神经醇,2012,32( 4) : 491-507。和其他研究表明缺氧诱导因子-1α和核因子-κB的P65亚单位直接促进环氧合酶-2和其他主要促炎因子在缺氧条件下的表达。金·[44]等人证实,在吸入OVA引起的炎症反应中,缺氧诱导因子-1α的表达水平增加,炎症细胞数量增加,气道高反应性和肺血管通透性增加,缺氧诱导因子-1α的抑制剂2-二甲氧基雌二醇可以逆转这一趋势。。托马斯·然而,其他研究人员认为缺氧诱导因子-1α在炎症性疾病中发挥抗炎作用。弗吕克·[45]和其他研究发现,在炎症性肠病的小鼠模型中,树突状细胞中HIF- 1α的特异性敲除可以增加促炎因子和粘蛋白的水平,显示更严重的肠道炎症反应,这表明HIF-1α可能具有抑制炎症反应的作用。在大鼠肺不张模型中,研究人员发现肺泡上皮细胞中缺氧诱导因子-1α的激活可以抑制肺不张引起的肺泡缺氧引起的炎症反应[46]。唐·[47]和其他研究表明,缺氧诱导因子-1α作用于肿瘤坏死因子-α,抑制血管扩张剂刺激的磷蛋白的表达,并减少肺部的急性炎症反应。基希拉·[48]和其他研究证实,缺氧诱导因子-1α的缺乏减少了脂肪组织中巨噬细胞的浸润和炎症反应。等人的研究证实,缺氧诱导因子-1α作用于肿瘤干细胞相关膜蛋白CD24,促进肿瘤生长和转移。Ke目前,学术界对缺氧诱导因子-1α与炎症的关系有不同的看法。作者认为缺氧诱导因子-1α在不同炎症性疾病中可能表现出不同的机制。如上所述,缺氧诱导因子-1α在胃肠炎症性疾病中促进其炎症反应,而缺氧诱导因子-1α在肺部炎症性疾病中发挥抗炎作用。目前,缺氧诱导因子-1α在炎症中的具体机制尚未完全阐明。随着研究的不断深入,有望为炎症性疾病的诊断和治疗开辟一个新的视角。等人发现缺氧诱导因子-1α和Sp1共同激活CD147基因启动子,导致CD147表达上调,从而促进上皮实体瘤的生长和转移。此外,荟萃分析6结论的结果表明,缺氧诱导因子-1α基因C1772T的多态性与癌症的组织学分级和淋巴结转移风险的增加有关,表明缺氧诱导因子-1α多态性也与肿瘤转移密切相关。,表明缺氧诱导因子-1α能改善急性心肌缺血的心功能。杜缺氧是诱发肿瘤转移的最重要因素之一。进一步研究缺氧诱导因子-1α新靶基因及其功能,有助于为侵袭性肿瘤提供新的治疗靶点。等人最近报道,缺氧诱导因子-1α通过调节新的靶基因复性酶对心肌缺血再灌注起保护作用,为缺血性心肌疾病患者的治疗策略提供了依据。等研究表明,慢性缺氧引起的高脂血症患者血清缺氧诱导因子-1α水平相应升高,并与肺动脉收缩压呈正相关。王建荣·此外,缺氧诱导因子-1α还通过在缺氧[23期间激活丙酮酸脱氢酶激酶1抑制细胞代谢,降低心肌耗氧量和提高心肌存活率。此外,caspase-3的激活、促凋亡基因(如bax)的上调和抗凋亡基因(如bcl-2)的下调发生在心肌缺氧环境中,通过死亡受体途径和线粒体途径导致心肌细胞凋亡,而缺氧诱导因子-1α的高表达可以逆转上述过程,通过在缺氧时激活PI-3K/Akt等途径降低凋亡率,从而增加缺氧区细胞的增殖率,发挥抗凋亡作用[24等人在慢性缺氧诱导的新生大鼠高脂血症模型中发现,缺氧3 d后新生大鼠肺组织中缺氧诱导因子-1α的表达明显高于对照组,缺氧7 d后新生大鼠肺血管发生重塑,提示缺氧诱导因子-1α参与了新生大鼠高脂血症的发生和发展。曹晶缺氧诱导因子-1α作为一种氧敏感转录调节因子,因其对缺血缺氧心肌的保护作用而被学术界所认可。对缺氧诱导因子-1α相关信号通路的深入研究将为缺血性心肌疾病的治疗提供新的视角。等研究发现,缺氧诱导因子-1α及其下游靶基因内皮素-1和iNOS在高脂血症新生大鼠肺组织中表达较多,提示缺氧诱导因子-1α在疾病的发病机制中起着重要作用。孙青·4缺氧诱导因子-1α和肿瘤和其他研究认为,肺动脉高压大鼠肺小动脉内膜增殖的机制与高强度因子-1α表达的上调和血管平滑肌细胞增殖的促进有关。。Yasuo缺氧诱导因子-1α在人乳头状瘤病发病中的调节作用在学术界基本相同。大量研究表明,缺氧诱导因子-1α在人乳头状瘤病的发病机制中起着核心作用。进一步研究缺氧诱导因子-1α及其靶基因与缺氧性肺血管收缩和肺血管重塑的关系,以及缺氧诱导因子-1α参与缺氧性细胞凋亡和增殖的机制,有助于从分子水平阐明缺氧诱导因子-1α的发病机制,从而为其临床诊断和治疗奠定基础。等研究指出,重度慢性阻塞性肺疾病患者肺组织、肺动脉内皮细胞和肺泡间质细胞中缺氧诱导因子-1α基因和蛋白的表达显著降低,这被认为与肺实质结构在分子水平上的损伤有关。魏文婷[等人的研究表明,缺氧诱导因子-1α的表达在慢性阻塞性肺疾病的发展过程中降低,这可能与疾病的发展有关。等研究表明,缺氧诱导因子-1α在慢性阻塞性肺疾病患者肺组织和血清中的表达增加,这与气流受限的严重程度呈正相关。王宏云·鉴于上述不同观点,作者认为缺氧诱导因子-1α在慢性阻塞性肺疾病中的表达可能与其基因多态性、不同人群和病程分期有关。轻中度慢性阻塞性肺疾病患者肺组织中缺氧诱导因子-1α表达上调,重度慢性阻塞性肺疾病患者肺组织中缺氧诱导因子-1α表达下调。进一步阐明缺氧诱导因子-1α基因多态性在慢性阻塞性肺疾病中的作用,对于寻找阻断慢性阻塞性肺疾病发生发展的新途径具有重要意义。等研究发现,缺氧诱导因子- 1α在慢性阻塞性肺疾病大鼠模型肺小动脉壁的表达显著增强,并与肺小动脉壁厚度和肺动脉压力相关,提示缺氧诱导因子-1α在慢性阻塞性肺疾病肺血管重塑中起重要作用。罗玲2.2缺氧诱导因子-1α与缺氧性肺动脉高压等研究表明,慢性阻塞性肺疾病患者外周血单核细胞中核因子κB和缺氧诱导因子-1的表达增加,缺氧诱导因子-1α在不同严重程度的慢性阻塞性肺疾病中稳定表达,表明慢性持续低氧可启动炎症反应和适应性保护机制。等人报道,缺氧诱导因子-1α通过诱导促凋亡蛋白和细胞因子如Nix、BNip3、il20等诱导脑缺血再灌注后线粒体功能障碍。,导致细胞坏死。等人报道,在短期脑血缺氧后,缺氧诱导因子-1α通过上调血管内皮生长因子和下调caspase-9发挥神经保护作用。PI3K、p38 MAPK和MEK通路参与缺氧诱导因子-1α和血管内皮生长因子的调节。在调节脑血管生成方面,Reisehl上述不同观点的原因可能与研究设计方法、实验方法、缺血缺氧条件和时间节点的差异有关。目前,大多数研究倾向于支持前一种观点。为了进一步阐明缺氧缺血性脑损伤中缺氧诱导因子-1α的作用机制,应建立一个标准的脑损伤模型,并考虑内外环境、区域和不同种族等因素。等研究表明,脯氨酸羟化酶抑制剂通过降低缺氧诱导因子-1α的降解,稳定缺氧诱导因子-1α的浓度,控制血管内皮生长因子和促红细胞生成素的表达,从而显著减少缺血性卒中后脑水肿和血管渗漏。
[4]
[5]
[6]
[7]
[8]
[9]
[10]
[11]
[12]
[13]
3缺氧诱导因子-1α与缺血缺氧性心肌疾病
[15]
[16]
[17]
[18]
[19]
[20]
[21]
[22]
4.2缺氧诱导因子-1α与肿瘤细胞凋亡
缺氧诱导因子-1α调节肿瘤细胞凋亡的机制在学术界有所不同。一些学者认为缺氧诱导因子-1α促进肿瘤细胞凋亡。据报道,缺氧诱导因子-1α可通过激活肿瘤缺氧区凋亡前体蛋白BNIP3和NIX诱导肿瘤细胞凋亡。研究发现p53与奇数结构域和缺氧诱导因子-1α[34’结合,通过调节Bax和其他蛋白质诱导p21介导的程序性细胞死亡或细胞生长抑制。李参考等研究表明,缺氧诱导因子-1α通过下调细胞周期蛋白B1、生存素和上调胱天蛋白酶-3促进肺癌细胞凋亡。
张晓楠·[1]奥贡索拉·奥,艾哈迈德·阿·希夫-1在血脑屏障:渗透性的介质[.高盐医学生物学,2012,13( 3) : 153-161。等研究发现,缺氧诱导因子-1α与胃癌组织中促凋亡蛋白BAK的阳性表达呈正相关,提示缺氧诱导因子-1α可能参与诱导胃癌细胞凋亡。然而,其他学者认为缺氧诱导因子-1α可以保护细胞免受缺氧诱导的凋亡,并在缺氧应激中发挥抗凋亡作用。Nardinocchi[2][2]王L,邓文,袁青,等.运动预处理通过上调缺氧诱导因子-1α的表达减少缺血再灌注诱导的局灶性脑梗死体积.PakJ Pharm Sci,2015,28( 2) : 791-798。等人发现缺氧诱导因子-1α可以通过下调HIPK2拮抗p53介导的凋亡。夏[3][3]张兵,尹春平,赵青,等.缺氧上调缺氧诱导因子-1α通过前莫婷生存素表达保护神经母细胞瘤细胞凋亡[[]。亚太癌症预防杂志,2014,15( 19) : 8251-8257。等报道,在恶性视网膜母细胞瘤中,血管内皮生长因子、谷氨酸转运体1和生存素基因的表达可通过抑制缺氧诱导因子-1α下调,从而抑制肿瘤细胞增殖,促进细胞凋亡。申[4][4]朱婷,詹磊,梁德,等.缺氧诱导因子1α介导缺氧后处理对全球脑缺血的神经保护作用.[.《神经病理学实验》,2014,73( 10) : 975-986。和其他研究表明,氯化钴(HIF-1α激动剂)抑制凋亡调节蛋白如Bax、Bcl-2、胱天蛋白酶-3、胱天蛋白酶-8、胱天蛋白酶-9和细胞色素C的表达,而IK(HIF-1α抑制剂)可以起到抗增殖和诱导凋亡的作用。
[26]
[27]
[28]
[29]
[30]
[31]
[32]
[33]
缺氧是哺乳动物体内最常见的病理生理反应。缺氧诱导因子-1α作为缺氧调节的关键转录调控因子,在细胞和系统水平如红细胞生成、肿瘤表达、细胞凋亡、炎症免疫和能量代谢中发挥重要作用。目前,虽然学者们对缺氧性疾病中缺氧诱导因子-1α的作用有不同的看法,但随着分子生物学技术的不断进步,相信缺氧诱导因子-1α在缺氧性疾病中的核心中枢作用将会进一步阐明。缺氧诱导因子-1α活性的调节可能成为未来各种疾病治疗的靶点,从而为治疗这些疾病提供新的思路和方法。
[35]
[36]
[37]
[38]
[39]
[40]
[41]
[42]
[43]


