药材合剂的实验结果,不得在生产或者销售的食品中添加药品、中药或者化学药品。...
药材合剂的实验结果
没有药物,中草药,化学药品,...不得在生产经营的食品中添加药品、中草药、化学药品和增白剂。请回答谢谢。不得在生产经营的食品中添加药品、中草药、化学药品和增白剂。请回答谢谢

中药合剂 名词解释
中药混合物是指将药材用水或其他溶剂通过适当的方法提取并浓缩而成的口服液制剂(单剂量包装机又称“口服液”) 它是在汤剂应用的基础上发展起来的新配方。 该中药合剂不仅是普通汤剂的浓缩产品,而且根据药物成分的性质,综合运输多种浸提配方。该中药混合物是由中药称重、加热、提取、浓缩、调整制成的口服液剂型,按照约定的处方和制备工艺要求制备而成。 煎煮提取是主要方法 为了提取尽可能多的活性成分,提高混合物的质量,并对患者有益,口服液:以中药汤剂为基础,从中药中提取成分,
不得在生产或者销售的食品中添加药品、中药或者化学药品。...
没有药物,中草药,化学药品,...不得在生产经营的食品中添加药品、中草药、化学药品和增白剂。请回答谢谢。不得在生产经营的食品中添加药品、中草药、化学药品和增白剂。请回答谢谢

中药合剂 名词解释
药材合剂的实验结果范文
本文的目录导航:
[标题]银黄陈二合剂制备工艺及质量标准研究
[第一章]黄芩和银华陈二
[研究简介第二章]药材研究材料和方法
[第三章]药材合剂实验结果
[第四章-参考文献]银黄二陈合剂研究结果的讨论与结论
3试验结果
3.1水提正交试验结果
正交试验优选结果为B1C2D2,即除黄芩外,以上5味,加处方量的8倍量水,加热至沸腾后加入黄芩,回流提取2次,每次2小时。结果见表2和表3.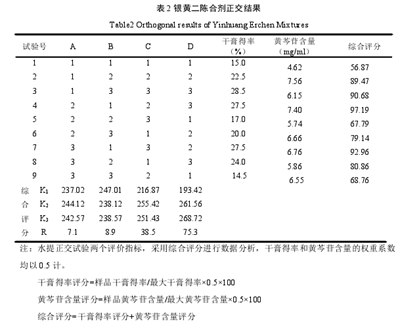
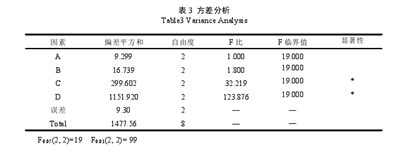
3.2干膏得率的检测结果
试验结果表明,干膏得率最高的为3号,即A1B3C3D3.
9种提取方案干膏得率及黄芩苷含量见表4.
3.3提取工艺验证结果
另取6批药材,分别按照正交筛选的最佳工艺条件及我们优选的工艺条件进行提取,各制备3批银黄二陈合剂样品。两种工艺制备的银黄二陈合剂样品的干膏得率和黄芩苷含量无显着差异,并保持相对稳定试验结果见表5.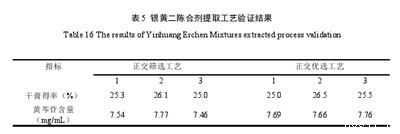
最终选定的工艺为:即除黄芩外,以上5味,加处方量的8倍量水,加热至沸腾后加入黄芩,回流提取2次,每次2小时。
3.4浓缩工艺研究结果
结果显示,浓缩后黄芩苷的平均保留率为77.0%,分析是浓缩后黄芩苷的溶解度下降,黄芩苷为淡黄色结晶,几乎不溶于水,在浓缩后水分减少及含量增高的情况下,部分析出沉降,造成损失。但是,不同浓缩条件下,黄芩苷的含量无显着变化,经计算,不同浓缩条件下,样品中黄芩苷的含量的RSD为1.74%,即4种浓缩工艺均可用于银黄二陈合剂的浓缩。见表17.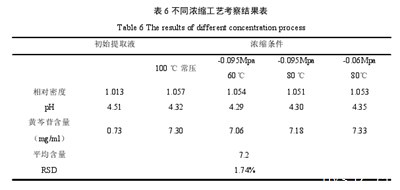
3.5浓缩工艺验证结
果经验证,压力-0.06 Mpa,温度80℃的减压浓缩方法用于银黄二陈合剂的浓缩步骤稳定可靠,符合生产要求。见表7.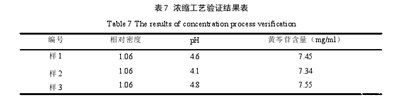
3.6防腐剂考察结果
结果表明,添加0.3%苯甲酸钠的防腐效果最好,优于其他两个浓度,因此最终选择添加0.3%苯甲酸钠。见表8.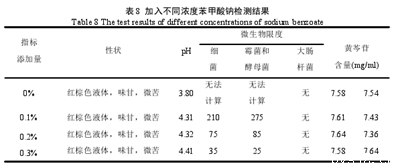
3.7生产工艺验证结果
按照以上工艺生产的三批小样,p H、相对密度、微生物限度、黄芩苷含量均符合规定。见表9.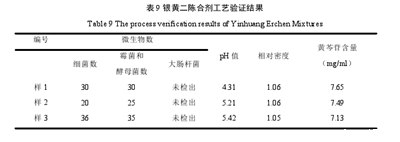 3.8薄层色谱鉴别结果
3.8薄层色谱鉴别结果
3.8.1黄芩和金银花的鉴别结果
3批供试品溶液色谱中,在与黄芩苷对照品色谱相应的位置上,显相同的黑色斑点,缺黄芩苷阴性对照溶液却没有该斑点;在与绿原酸对照品色谱相应的位置上,显相同的蓝色斑点,缺绿原酸阴性对照溶液却没有该斑点。试验结果见图1.
结果表明,3批供试品中均检出黄芩和金银花,斑点清晰、分离度好,比移值适中,且阴性样品无干扰,经重复试验,所得结果一致。
3.8.2甘草的鉴别结果
日光下,3批供试品溶液色谱中,在与甘草苷对照品色谱相应的位置上,呈现相同的黄色斑点,缺甘草阴性对照溶液却没有该斑点。见图2.
结果表明,3批样品均检出甘草,斑点清晰、分离度好,比移值适中,且阴性样品无干扰,经重复试验,所得结果一致。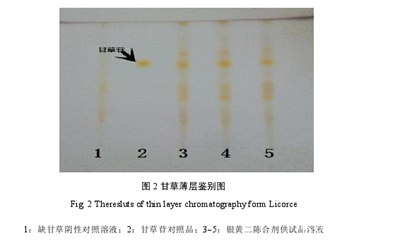
2.8.3陈皮的鉴别结果
紫外光灯下,供试品色谱与对照品溶液色谱相应的位置上,呈现相同颜色的荧光斑点。而阴性对照溶液色谱相应的位置上,无相同的斑点显示。见图3.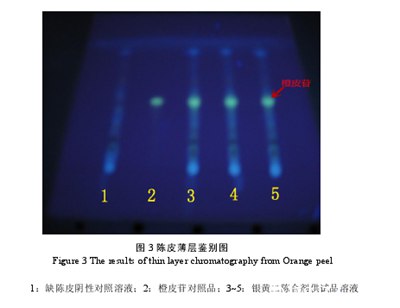
结果表明:
3批样品均检出陈皮,该斑点清晰、圆整,分离度好,比移值适中,且阴性对照样品无干扰,经重复试验,所得结果一致。
3.9 p H检测结果
根据测定结果,规定p H值应为3.5~5.5.见表10.
3.10相对密度的测定结果
结果显示,本品相对密度不小于1.04.见表11.
3.11微生物限度检测结果
结果表明,3批样品微生物限度检查均符合规定。见表12.
3.12含量测定方法研究结果
3.12.1系统适用性测定
结果表明:黄芩苷与相邻峰达到基线分离,分离度达到2.88,黄芩苷峰保留时间为7.220 min,理论板数为4335,峰面积为2291181,峰高为127292.试验证实,该方法系统适用性良好。

3.12.2阴性干扰测定
实验结果:阴性样品在与对照品色谱峰相应的位置上,无吸收峰,说明处方中其它成分不影响黄芩苷的含量测定。
3.12.3线性关系测定结果
见表13.

以峰面积为纵坐标,黄芩苷含量(X-mg/m L)为横坐标作线性回归,回归方程为:
y=20000000x + 9669,r = 0.9999,结果表明,黄芩苷在0.04~0.40 mg/m L(0.2~2.0 μg)范围内,峰面积与黄芩苷含量呈良好的线性关系。见图4.
3.12.4精密度测定试验
结果显示,精密度试验的相对标准偏差RSD为0.53%,精密度复核要求,结果见表14.

3.12.5重复性测定
6份样品相对偏差RSD为0.65%,重复性符合规定,结果见表15.
3.12.6溶液稳定性测定
供试品24小时内峰面积相对标准偏差RSD为0.69%,样品溶液在24小时内稳定。结果见表16.
3.12.7加样回收率测定
结果表明,6份样品黄芩苷的平均回收率为100.1%,RSD为1.06%,回收率试验符合规定。见表17.

3.12.8耐用性测定结果
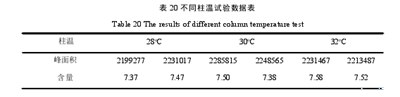
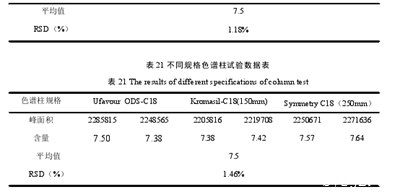
同一供试品改变流动相比例后,RSD为2.09%,测定结果见表18;同一供试品在3个波长下,RSD为0.76%,测定结果见表19;同一供试品在改变柱温的条件下,RSD为1.18%,测定结果见表20;同一供试品在更换不同色谱柱下进行测定,RSD为1.46%,测定结果见表21.结果表明,该方法耐用性良好。
3.12.9含量限度的测定
根据银黄二陈合剂含量限度的公式计算:含量限度=药典规定的药材含量×平均转移率(%)×每1 m L样品中含黄芩药材的量(mg)=9.0%×41.6%×180=6.7 mg.上述试验结果可以看出,从10批本品随机选取的20个样品,样品中黄芩苷的含量全部在7.02~8.30 mg/m L,最低含量为7.02 mg/m L.见表22.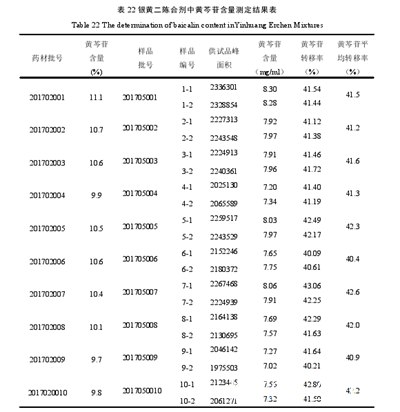
我们结合样品检测结果、药材含量及工艺转移率的因素,因此建议本品的含量限度规定为:本品每l m L含黄芩以黄芩苷(C21H18O11)计,不得少于7.0 mg.
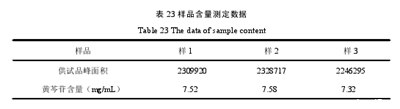
3.12.10样品含量测定
结果见表23.