胚胎干细胞构建遗传疾病模型的意义探讨,胚胎干细胞的遗传物质在质量和数量上与受精卵相同。
胚胎干细胞构建遗传疾病模型的意义探讨
胚胎干细胞的遗传物质在质量和数量上与受精卵相同:指染色体的物质和基因的数量:指染色体数量的组合,这意味着遗传物质是相同的。

干细胞的作用
干细胞有两种用途:(1)治疗遗传性疾病和恶性肿瘤;(2)用干细胞作为种子培养移植医学中使用的组织和器官。扩展数据:干细胞是原始的未分化细胞,是一种未完全分化的细胞,具有再生各种组织和器官的潜在功能。 干细胞,
胚胎干细胞的遗传物质在质量和数量上与受精卵相同。
胚胎干细胞的遗传物质在质量和数量上与受精卵相同:指染色体的物质和基因的数量:指染色体数量的组合,这意味着遗传物质是相同的。

干细胞的作用
胚胎干细胞构建遗传疾病模型的意义探讨范文
关于遗传疾病的第二篇论文
主题:探讨胚胎干细胞在构建遗传病模型中的意义
摘要:背景:胚胎干细胞是具有发育多能性和无限自我更新能力的多能干细胞,广泛应用于生物学领域的各种研究。目的:总结胚胎干细胞体外培养和人胚胎干细胞遗传病模型构建的意义、方法、应用及发展前景。方法:在标题和摘要中,以“胚胎干细胞,遗传病”为主题检索词,检索Pub Med数据库中所有与胚胎干细胞相关的文献。应该优先考虑最近在权威杂志上发表的文章。结果与结论:在遗传学领域,由人胚胎干细胞构建的遗传病模型已被广泛应用于单基因遗传病和染色体异常的研究,可以克服传统动物模型和细胞模型的局限性,更有利于遗传病病理过程和分子机制的研究。然而,由于人类胚胎干细胞的来源是植入前的早期胚胎,因此对其应用也存在一些伦理争议,人们仍在对其进行探索。
关键词:胚胎干细胞;遗传病;疾病模型;干细胞;
主题词:胚胎干细胞;模型,遗传学;组织工程;

胚胎干细胞与遗传病模型的构建
邱佳卉谭继春
中国医科大学盛京医院生殖中心生殖二科
摘要:
背景:胚胎干细胞是一种多能干细胞,可分化为所有细胞类型,并在体外无限增殖,已广泛应用于生物学研究。目的:总结胚胎干细胞体外培养方法,以及胚胎干细胞作为遗传病模型的意义、方法和临床应用。方法:用标题和摘要中出现的关键词“胚胎干细胞,遗传病”检索《公共医学》中的相关文章。最新的文章更受欢迎。共获得43篇合格文章进行结果分析。结果与结论:在遗传学研究中,胚胎干细胞被广泛用于构建单基因和染色体疾病模型,弥补了动物和细胞模型的局限性。胚胎干细胞构建的模型有助于研究遗传疾病的病理过程和分子机制。但在胚胎干细胞的使用上也存在一些伦理争议,需要进一步研究。
快速阅读文章:
胚胎干细胞在遗传病模型构建中的应用
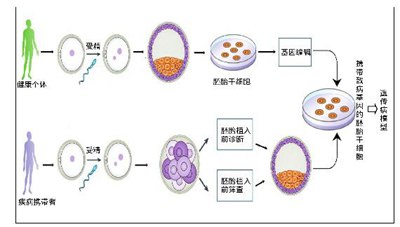
文本解释:
胚胎干细胞:在体外特定条件下植入前,通过在哺乳动物胚泡中培养和扩增细胞团而获得的多能干细胞。在体外培养中,胚胎干细胞可以长时间自我复制,并保持其多向分化的潜力。目前,胚胎干细胞主要用于早期胚胎发育研究、再生医学和疾病模型的构建。
诱导多能干细胞(iPSCs)是一类通过体细胞体外重编程获得的具有自我复制和再生能力的多能细胞。通过将4种特异性转录因子OSMK (Oct4,Sox2,Kl4和c-Myc)转移到成体细胞中,成体细胞恢复到多能性。与胚胎干细胞相似,诱导多能干细胞在一定条件下可以分化成多种组织细胞。因此,诱导多能干细胞也可用于构建遗传病模型,并广泛用于疾病发病机制的探索、药物筛选等。利用患者遗传物质的改变建立人诱导多能干细胞系是遗传病研究的一个非常重要的手段。由于外源基因的引入和重编程效率的存在,诱导多能干细胞的应用也受到严重限制。近年来,随着技术的发展,重编程技术也得到了提高。然而,与胚胎干细胞相比,两者仍有各自的优缺点,并且相互补充更有利于遗传病的研究。
0简介
胚胎干细胞是在体外特定条件下,植入前培养并扩增哺乳动物胚泡内细胞团而获得的多能干细胞。它具有发育多能性和无限的自我更新能力,广泛应用于胚胎发育、干细胞治疗、遗传疾病等生物领域的各种研究。随着胚胎干细胞体外培养技术的发展,人们逐渐探索出诱导胚胎干细胞“全能性”的方法和机制,使得胚胎干细胞具有很高的研究和应用价值。在遗传学领域,研究人员利用人类胚胎干细胞构建遗传病的细胞模型,可以有效弥补传统动物模型和细胞模型的局限性。胚胎干细胞具有多向分化的潜力。通过改变体外培养条件,可以诱导它们分化成各种类型的细胞,这可以进一步用于研究遗传疾病的机制。此外,可以通过这种胚胎干细胞衍生的遗传病细胞模型进行体外药物筛选,为遗传病的治疗提供了新的希望。本文综述了人胚胎干细胞体外培养和人胚胎干细胞遗传病模型构建的意义、方法、应用和发展前景。
1数据和方法
1.1来源
作者使用计算机在公共医学数据库(https://www.ncbi.nlm.nih.gov/pubmed)中搜索相关文档。搜索时间不受限制,搜索术语为“内生性干细胞,遗传病建模”,共检索到205篇文献。
1.2选择标准
纳入标准:(1)标题或摘要中与胚胎干细胞培养和遗传病模型建立相关的文件;②论据、依据可靠,发表在权威杂志上。
排除标准:(1)重复文件;(2)除经典文献外,发表时间太久的文献;(三)其他领域胚胎干细胞模型建立的相关文件。
1.3质量评估
共检索到205份文件。阅读标题和摘要后,根据排除标准对它们进行筛选,以排除那些不符合研究目标并重复出现的文件。然后仔细阅读全文,根据入选标准选择43篇文献进行总结。
2结果
2.1胚胎干细胞
2.1.1胚胎干细胞的特征
胚胎干细胞是在体外特定条件下,植入前在哺乳动物胚泡中培养和扩增细胞团而获得的多能干细胞。Evans等人[1]早在20世纪80年代早期就成功地从小鼠胚泡中分离出小鼠胚胎干细胞。马丁等人[2]几乎同时建立了小鼠胚胎干细胞系。后来,研究人员从其他哺乳动物中分离出胚胎干细胞。然而,人类胚胎干细胞的分离并不像预期的那样顺利。1994年,邦索等人[从人类胚泡的内部细胞团中分离出人类胚胎干细胞,但不幸的是,他们没有成功建立该系统。直到1998年,研究人员才成功地从体外受精5天的人类胚泡中分离出第一个人类胚胎干细胞系[4]。胚胎干细胞有两个基本特征:无限的自我更新能力和分化的多能性。在体外培养中,胚胎干细胞可以长时间自我复制,并保持其多向分化的潜能。目前,胚胎干细胞主要用于早期胚胎发育研究、再生医学和疾病模型的构建。
2.1.2胚胎干细胞的获取和培养
随着技术的发展,已经建立了数百个人胚胎干细胞系。人胚胎干细胞来源于胚泡期的内部细胞团。主要有两种方法获得它们:免疫手术和机械分离。动物源性产品用于免疫手术,这容易造成动物源性污染,导致获得的人胚胎干细胞在后续应用中受到限制。机械手术能有效避免这一问题,更适合临床应用的人胚胎干细胞培养[5】。此外,激光钻孔法也适用于内部细胞团的分离[6]。
人胚胎干细胞的体外培养过程不仅要保持胚胎干细胞的自我更新能力,还要保持其多能性。因此,人胚胎干细胞的培养需要特殊的培养液和饲养层支持。通常需要在培养液中加入一些能抑制胚胎干细胞分化的因子,如白细胞抑制因子。研究表明饲养层也能分泌特殊的生长因子来维持胚胎干细胞特性[7,8,9,10,11]。除去这些可以抑制胚胎干细胞分化的因素,胚胎干细胞可以通过体外悬浮培养分化成含有三胚层组织结构的胚状体,[12]。1998年,通过选择小鼠胚胎成纤维细胞作为饲养层[4]建立了第一个人胚胎干细胞系。这种饲养层至今已被使用,但为了消除动物源性干扰,在人胚胎干细胞的培养中(图1),人们也开始尝试使用人源性细胞作为饲养层,如输卵管上皮细胞、胎儿肌肉细胞、骨髓、羊膜上皮细胞、人皮肤成纤维细胞、胎盘成纤维细胞等。[13,14,15,16,17]。近年来,研究人员也开始尝试无饲养的培养方法。通过在培养瓶中加入适量的基质胶,在培养基中加入一定的生长因子,实验证明无饲养层培养条件可以使胚胎干细胞在多次传代后保持其形态和多能性,具有稳定的核型,并能形成胚体分化为内胚层、外胚层和中胚层[18]。
图1人胚胎干细胞的体外培养[17]

注:在图中,甲和乙是胚泡;c是第7天在饲养层上生长的胚泡;d是胚胎干细胞克隆;e是传代后的克隆(比例:α,β= 100 μm;c,D,E=200μm).
胚胎干细胞的体外培养是一个非常复杂和微妙的过程。在一些早期研究中,体外培养的胚胎干细胞只有体外发育的潜力。2017年1月,加州大学伯克利分校何林教授的研究团队在《科学》杂志上发表了一篇研究论文报告。通过去除名为mi R-34a的微小核糖核酸,小鼠胚胎干细胞成功地显示出与受精卵相似的发育特征,并能分化为胚胎组织和胚胎外组织[19]。然而,2017年4月发表在《细胞》(Cell)上的一篇文章的研究结果突破了人类胚胎干细胞体外培养的局限。在这项研究中,邓鸿魁等人通过筛选建立了一个叫LCDM的文化体系。该培养系统可以诱导小鼠和人类干细胞系的产生,这些干细胞系具有体外和体外发育潜力,该团队称之为扩展多能干细胞[20]。最近的一项研究表明,胚胎干细胞的潜能可能与pramel7蛋白的表达有关,pramel 7蛋白通过介导脱氧核糖核酸甲基化来决定胚胎干细胞的分化状态。因此,物种体外培养过程可以通过影响pramel7 [21,22]的表达使体外培养的胚胎干细胞具有“全能性”。
2.1.3胚胎干细胞的细胞学鉴定
鉴定了胚胎干细胞的基本形态、生长特性、核型、多能性和表面标记。它通常包括以下几个方面:(1)细胞的来源;(2)细胞在体外培养过程中能保持稳定增殖而不分化;(3)体外长期培养后的核型分析;(4)体内或体外多向分化潜能;(5)oct-4、NANOG、SOX2等基因的表达,[23,24]。目前,鉴定胚胎干细胞的常用生物学方法包括碱性磷酸酶染色实验、细胞免疫荧光、流式细胞术、胚状体实验、体外畸胎瘤形成实验、核型分析等。
2.2利用人胚胎干细胞构建遗传病的意义
遗传病是一种以遗传物质变化为特征的疾病,具有先天性、终身性和家族性。中国是一个遗传病发病率高的国家,有1/4-1/5的人口患有各种类型的遗传病。每年出生的先天性残疾儿童总数高达80万至120万,占每年出生总人口的4%-6%。遗传病严重降低了儿童的生活质量,给家庭和社会造成了严重的经济和精神负担。在迄今发现的7000种罕见疾病中,80%是由严重威胁人类健康的基因变异引起的。根据细胞不同层次遗传物质的变化,可分为染色体疾病、单基因疾病、多基因疾病和体细胞遗传疾病。目前,遗传病的研究方法主要包括细胞模型、动物模型构建和分子水平研究。由于小鼠基因编辑操作简单,与体外细胞模型相比,小鼠模型可以获得更全面的信息,小鼠模型得到了广泛的应用。然而,由于物种特异性,人和小鼠在发育、遗传和生理上有很大差异[25]。这导致通过基因编辑构建的人类遗传病小鼠模型有时不能产生与人类相同的表型。例如,具有囊性纤维化突变的小鼠通常在出现呼吸症状之前死于肠梗阻,并且通过基因编辑获得的小鼠Lesch-Nyam综合征模型通常不显示与人类相似的症状[26]。非整倍性通常会导致人类流产,而只有一条染色体的小鼠可能会在[生存27]。同时,Perel等人[28]也质疑动物实验的有效性,比较了临床试验和动物实验中相同治疗方法的治疗效果,发现两者在某些疾病中的治疗效果不一致。另一方面,研究中使用的细胞模型通常取自患者的体细胞。由于发病特点和伦理限制,一些疾病局限于携带某种疾病表型的原代细胞来源,经常存在分离困难和体外长期培养等问题,因此很难构建理想的细胞模型。Thomson等人在1998年成功地分离了人类胚胎干细胞,这为克服上述疾病模型的问题提供了一种新的策略。
2.3利用人胚胎干细胞构建遗传病模型的方法
2003年,兹瓦卡等人[29]发表了第一篇关于人类胚胎干细胞同源基因重组的文章。随后,乌尔巴赫等人[30]利用人类胚胎干细胞构建了莱什-尼汉姆综合征的疾病模型。从那时起,人们已经开始通过人类胚胎干细胞的核基因组编辑来构建携带致病基因的各种类型的胚胎干细胞系。然而,由于基因打靶技术的局限性,人类胚胎干细胞的基因编辑效率不高。目前常用的基因编辑方法包括锌指核酸酶技术、转录激活样效应核酸酶技术和聚类规则间隔短回文重复技术。三种方法的推广应用显著提高了胚胎干细胞的基因编辑效率,为利用胚胎干细胞构建遗传病细胞模型提供了更加坚实的基础。另一方面,近年来,随着人类辅助生殖技术的应用,产前基因诊断(PGD)和产前基因筛查(PGS)可用于获得含有特定基因变异的人类胚胎干细胞。这些人类胚胎干细胞取自废弃的胚胎,成功避免了伦理争议,因此被广泛用于构建人类遗传病模型。目前,PGD/PGS技术已经用于建立具有各种遗传疾病的细胞系,如马凡综合征、脆性X染色体综合征、良性假肥大型肌营养不良、血友病B、囊性纤维化、肌强直性营养不良等。[31,32,33,34,35]。除了上述两种方法之外,Tachibana等人在2014年通过将体细胞核移植到去核卵母细胞中,成功建立了多能干细胞。这种干细胞与胚胎干细胞具有相似的性质,理论上可以应用于遗传病模型的建立。携带致病基因的胚胎干细胞可以在体外分化成各种类型的成体细胞,然后模拟遗传病的发生和发展,以探索遗传病的特征,寻找治疗疾病的新方法。
2.3.1常见基因编辑技术
锌指核酸酶,ZFN)技术:锌指核酸酶是第一代人工限制性内切酶,由锌指脱氧核糖核酸结合域和限制性内切酶脱氧核糖核酸切割域组成。研究者可以根据不同的靶基因设计特定的锌指核酸酶。这项技术可以用来引入目标基因以及敲除目标基因。锌指核酸酶技术简单易行,特异性高,基因编辑效率高。但与此同时,锌指核酸酶技术也有许多缺点,最显著的问题是它在基因剪切过程中有很高的缺失靶效应,导致核酸内切酶不能识别和切割靶基因,最终可能导致脱氧核糖核酸错配和序列改变[37]。
转录激活剂样效应核酸酶(TALEN)技术:转录激活剂样效应核酸酶被认为是人工合成的第二代限制性内切酶,与锌指核酸酶相似。这种嵌合核酸酶由两部分组成,即一个可编码的序列特异性脱氧核糖核酸结合模块和一个非特异性脱氧核糖核酸切割结构域。通过诱导脱氧核糖核酸双链断裂,刺激易出错的非同源末端连接或在特定基因的位置进行同源定向修复。在一项研究中,锌指核酸酶技术和转录激活样效应物核酸酶技术分别应用于相同的基因位点CCR5。与锌指核酸酶技术相比,转录激活样效应核酸酶技术对CCR2具有较低的缺失效应,CCR 2是CCR5 [38]的类似作用位点。转录激活样效应核酸酶技术的缺点在于其分子量大,这在将其运输到细胞中时造成一些困难,从而限制了其应用。
群集规则间隔短回文重复(Crispr)技术:该系统最初发现于细菌的天然免疫系统中,其主要功能是抵御入侵病毒和外来脱氧核糖核酸,并能特异性降解它们,从而发挥抗病毒作用[39,40]。CRISPR/Cas系统由CRISPR序列元件和Cas基因家族组成。目前,CRISPR/Cas系统有三种类型,2类系统是目前研究和应用最广泛的,即CRISPR/Cas9系统。不同于锌指核酸酶和转录激活样效应核酸酶,它可以完成核酸导向的核酸识别和编辑。该技术具有靶向准确、失败率低、细胞毒性低、价格高等优点。但是,也存在一些缺点,如特异性低,易产生随机毒性。
3基因编辑方法的比较见表1。
表1三种基因编辑方法的比较

2.3.2植入前遗传诊断和植入前非整倍体筛查(PGD/PGS)
植入前遗传诊断(PGD)是指通过体外受精技术获得的染色体疾病或遗传病夫妇的卵子或早期胚胎的遗传分析,选择不携带致病基因的胚胎植入子宫,从而避免遗传病儿童的出生。非整倍体植入前基因筛查(PGS)是指在胚胎植入前通过分析早期胚胎的染色体数目来检测胚胎是否具有正常的染色体数目,从而选择具有非整倍体的胚胎植入子宫,可以提高辅助生殖治疗中预后不良的妇女的辅助妊娠成功率,有效降低流产率。
2.4利用人胚胎干细胞构建不同类型的遗传病及其应用
人类胚胎干细胞是遗传疾病的良好载体。目前,人类胚胎干细胞更适合建立单基因遗传病和染色体异常遗传病的模型。人类胚胎干细胞的疾病相关致病基因主要编辑于[30],或者胚胎干细胞是通过使用PGD/PGS技术[41,42]诊断有问题的胚胎而获得的。目前,由于多基因遗传病的复杂性,还没有有效的诊断方法,因此利用胚胎干细胞建立多基因遗传病的疾病模型仍然是一个挑战。人类胚胎干细胞遗传病模型的建立可以弥补传统遗传病模型的不足。通过体外再分化模拟疾病的发生发展过程,不仅可以用于了解疾病的相关机制,还可以用于药物筛选,促进新药的研发。它是遗传病领域研究的有效方法。
3讨论
人类胚胎干细胞作为一种多能干细胞,已经引起了人们的广泛关注。它可应用于生物学领域的各种研究,如胚胎发育、干细胞治疗、遗传病研究等。然而,尽管人类胚胎干细胞有许多优点,但它们总是受到伦理道德的限制。一些国家甚至禁止胚胎干细胞的研究。诱导多能干细胞的出现使得胚胎干细胞的研究更加缺乏吸引力。诱导多能干细胞取自成人体细胞。通过慢病毒、逆转录病毒、仙台病毒、自由载体和其他方法对细胞进行重新编程,使得细胞表达四种特异性转录因子OKSM (Oct4、Sox2、Kl4和c-Myc),从而使它们能够“再生”并恢复其多能性[43]。诱导多能干细胞具有与胚胎干细胞相似的特性。研究人员经常使用遗传病患者的体细胞诱导多能干细胞,这可以用来建立遗传病模型,避免人类胚胎干细胞引起的伦理问题。但是人类胚胎干细胞会从历史舞台上消失吗?结果是否定的,主要是由于以下因素:(1)诱导多能干细胞的操作过程非常复杂,重编程效率低,目前,诱导多能干细胞仍然延续着胚胎干细胞的技术路线,其应用还有很长的路要走;(2)PGD诊断后从废弃胚胎中获得的人类胚胎干细胞避免了伦理问题,且过程相对简单。随着科技的发展和对遗传病的认识,PGD可以辅助更多种类的遗传病,这意味着可以用更多的遗传病来建立人类胚胎干细胞的疾病模型。(3)目前的研究表明,来源于不同成体细胞的诱导多能干细胞都具有来源组织的记忆效应,诱导多能干细胞并不完全等同于胚胎干细胞;(4)人类胚胎干细胞和诱导多能干细胞在建立同一疾病的疾病模型中的比较结果可以表明表观遗传学对疾病的影响。这两种干细胞在遗传病研究中各有利弊,可以互补,更有利于遗传病的研究。因此,诱导多能干细胞不能完全替代人类胚胎干细胞。相反,人类胚胎干细胞可以作为黄金标准来指导诱导多能干细胞的发展。目前,随着科学工作者的深入探索和生物技术的发展,胚胎干细胞的培养效率在过去几十年中显著提高,为胚胎干细胞的蓬勃发展提供了有利和必要的基础条件。近年来基因编辑技术的不断创新为胚胎干细胞的研究提供了新的方向和平台。因此,胚胎干细胞在遗传学领域仍有很大的研究前景。
参考
[1]埃文斯·乔丹,考夫曼·MH。小鼠胚胎多潜能细胞培养体系的建立。《自然》,1981年;292 (5819) :154-156。
[2]马丁·格雷。从在畸胎瘤干细胞条件培养基中培养的早期小鼠胚胎中分离多能细胞系。美国国家科学院院刊,1981年;78 (12) :7634-7638。
[3]邦松阿,方赛,吴世昌,等。人胚泡内细胞团细胞的分离和培养。哼哼,1994年;9 (11) :2110-2117。
[4]汤森贾,伊茨科维茨-埃尔多杰,夏皮罗斯,等。来源于人类胚泡的胚胎干细胞系。科学,1998年;282 (5391) :1145-1147。
[海峡?内部细胞团的机械分离在衍生新的人类胚胎干细胞系中是有效的。哼哼,2007年;22 (12) :3051-3058。
[6]泰斯泰格,拉斯·BH,劳芬伯格等人。激光辅助选择和传代人类多能干细胞集落。j生物技术酚,2009年;143 (3) :224-230。
[7]林JW,博德纳尔。支持人类胚胎干细胞生长的小鼠胚胎成纤维细胞饲养层条件培养基的蛋白质组分析。蛋白质组学,2002年;2 (9) :1187-1203。
[8]许若红,派克瑞姆,李德思,等。基础FGF和骨形态发生蛋白信号的抑制维持人胚胎干细胞的未分化增殖。Nat方法,2005年;2 (3) :185-190。
[9]蔡军,陈军,刘勇,等.评估人胚胎干细胞系的自我更新和分化.干细胞,2006年;24 (3) :516-530。
[10]陈亚奇,方WJ,高磊,等。从支持人类胚胎干细胞的饲养条件培养基中鉴定蛋白质。j生物技术酚,2007年;130 (3) :320-328。
[11]朴Y,金·JH,李士杰等。人饲养细胞可以利用自身的碱性成纤维细胞生长因子支持人和小鼠胚胎干细胞的未分化生长。干细胞发展,2011年;20 (11) :1901-1910年。
[12]Itskovitz-Eldor J,Schuldiner M,Karsenti D,等.人类胚胎干细胞分化为胚状体,危及三个胚胎胚层.Mol Med.20006 (2) :88-95。
[13]阿米特·M,玛格利特斯五世,塞格夫·H等。人类胚胎干细胞的人类饲养层。Biol Reprod.200368 (6) :2150-2156。
[14]程磊,哈蒙德·海,叶兹,等。人类成人骨髓细胞支持人类胚胎干细胞在培养物中的长期扩增。干细胞,2003年;21 (2) :131-142。
[15]根巴切夫·奥,克尔托利卡·阿,兹德拉夫科维奇·特,等.人胎盘成纤维细胞饲养层上人胚胎干细胞系的无血清衍生。Fertil Steril.200583 (5) :1517-1529。
[16]昂格尔,费尔丁,努登斯克?人胚胎干细胞饲养细胞人皮肤成纤维细胞系的衍生。Curr协议干细胞生物学2008;第1章:单元1C.7
[17]赖德,王勇,孙军,等.人胚胎干细胞对人羊膜上皮细胞的衍生和表征。Sci代表2015;5:10014。
[18]纳奇拉提斯,拉贾拉克,皮赫拉詹?人类胚胎干细胞动态生长的监测和分析:自动化仪器和常规培养方法的比较。生物医学工程在线,2007年;6:11。
[19]蔡YJ,林CP,里索D,等。微小核糖核酸m1 R-34a的缺乏扩大了多能干细胞的细胞命运潜力。科学,2017年;355 (6325) :eaag1927。
[20]杨Y,刘兵,徐军,等。体内胚胎和胚胎外潜能多能干细胞的衍生。Cell.2017169 (2) :243-257。
[21]格拉夫,卡萨诺瓦,怀克,等。勘误表:pramel 7通过蛋白酶体-表观遗传学联合途径介导基态多能性。Nat Cell Biol.201719 (8) :1003。
[22]格拉夫,卡萨诺瓦,怀克,等。普拉克7通过蛋白酶体-表观遗传学联合途径介导基态多能性。Nat Cell Biol.201719 (7) :763-773。
[23]王z,奥龙,尼尔森,等。纳米金,辛基4和SOX2在人类胚胎干细胞中的独特谱系规范作用。细胞干细胞,2012年;10 (4) :440-454。
[24]西尔瓦·杰,尼科尔斯·杰,Theunissen TW,等人。Nanog是通向多能基态的大门。Cell.2009138 (4) :722-737。
[25]小鼠基因组测序联盟1,沃特斯顿RH,林德布拉德-托赫K,等。小鼠基因组的初步测序和比较分析。《自然》,2002年;420 (6915) :520-562。
[26]威尔逊·JM。用于基因治疗的人类疾病动物模型。《临床投资》,1996年;97 (5) :1138-1141。
[27]辛格·特纳综合征。英国医学杂志,1996年;335 (23) :1749-1754。
[28]佩雷斯,罗伯特,塞娜,等。动物实验和临床试验治疗效果的比较:系统综述。BMJ.2007334 (7586) :197。
[29]日瓦卡TP,汤姆森贾。人胚胎干细胞中的同源重组。Nat Biotechnol,2003年;21 (3) :319-321。
[30]厄巴奇,舒尔丁纳,本维尼斯丁。人类胚胎干细胞基因打靶对莱什-尼汉病的建模。干细胞,2004年;22 (4) :635-641。
[31]皮克林SJ,明格尔S1,帕特尔M,等。利用植入前遗传诊断产生编码囊性纤维化突变F508的人胚胎干细胞系。《生物医学在线》再版,2005年;10 (3) :390-397。
[32]马泰泽一,德·特梅尔曼等人,从体外受精后和PGD后获得的胚胎中获得人类胚胎干细胞系,用于单基因疾病。哼哼,2006年;21 (2) :503-511。
[33]阿维祖尔·米,莫尔-沙克·赫,扬诺夫斯基-达甘·斯等。fmr1表观遗传学沉默通常发生在未分化的脆性受X影响的胚胎干细胞中。干细胞报告,2014年;3 (5) :699-706。
[34]杨青,周霞,周海,等.马凡综合征患者捐赠的异常胚泡来源的人胚胎干细胞。干细胞研究2015;15 (3) :640-642。
[35]Hmadcha A,Aguilera Y,Lozano-Arana MD,等.人类胚胎干细胞系从植入前单基因疾病遗传诊断(PGD)后的体外受精胚胎衍生而来。干细胞研究2016;16 (3) :635-639。
[36]塔奇巴纳·姆,阿玛托·帕尔曼·姆,等.通过体细胞核移植获得的人类胚胎干细胞。Cell.2013153 (6) :1228-1238。
[37]金俊,李HJ,卡罗尔。基因组编辑与模块化组装锌指核酸酶。Nat方法,2010年;7 (2) :91。
[38]穆索里诺·C,莫比特泽·R,吕特格·F,等。一种新型的TALE核酸酶支架能够实现高基因组编辑活性和低毒性。核酸第2011号决议;39 (21) :9283-9293。
[39]巴兰古·R,弗雷莫克斯·C,德沃·H,等。CRISPR在原核生物中提供对病毒的获得性抗性。科学,2007年;315 (5819) :1709-1712。
[40]Haft DH,Selengut J,Mongodin EF,等.原核基因组中存在45个CRISPR相关(Cas)蛋白家族和多个CRISPR/Cas亚型的行会。PLo S Comput Biol.20051 (6) :e60。
[41]Eiges R,Urbach A,Malcov M,等.利用来自植入前基因诊断胚胎的人类胚胎干细胞进行脆性X综合征的发育研究.细胞干细胞,2007年;1 (5) :568-577。
用人类胚胎干细胞研究45,XO(特纳综合征)胚胎的早期致死性。巴解组织第一届会议,2009年;4 (1) :e4175。
[43]俞军,冯德亚尼克,舒马-奥托·金,等.来源于人体细胞的诱导多能干细胞系。科学,2007年;318 (5858) :1917-1920。
范·文怡:遗传病论文(6篇独家整理)
范文2:胚胎干细胞在构建遗传病模型中的意义探讨
范文三:单基因遗传病分子诊断技术发展研究
范文4:探索男性染色体结构和数量异常
范文5:探讨基因工程治疗遗传病的发展前景



