热力学第一定律的适用条件,热力学第一定律的适用条件
热力学第一定律的适用条件
热力学第一定律的适用条件热力学第一定律本质上等同于能量守恒定律。这是一个普遍的法律,适用于宏观和微观世界的所有系统和所有形式的能源。自1850年以来,科学界已经认识到能量守恒定律是自然界的普遍规律之一。能量的守恒和转化定律可以表达如下:自然界中的所有物质
热力学第一定律只适用于
热力学第一定律适用于所有形式的能量。 热力学第一定律是能量在传递和转化过程中不同形式的守恒定律,表达式为△U=Q+W 表达形式:热量可以从一个物体传递到另一个物体,也可以用机械能或其他能量旋转。当能量守恒定律应用于热力学时,它是热力学第一定律。 换句话说,热力学第一定律是热现象过程中能量转换与守恒定律之间的具体定量关系,即内能与其他形式能量转换之间的定量关系 这个定律表明热力学第一定律适用于任何热力学系统从一种状态变化到另一种状态的相同过程的任何方式。 热力学第一定律意味着实验已经证明,当一个系统从状态a变为状态b时,它可以做功和传热。不管走哪条路,只要确定了开始和结束状态,功和传热的总和就保持不变。当能量守恒定律应用于热力学时,它是热力学第一定律。 换句话说,热力学第一定律是热现象过程中能量转换与守恒定律之间的具体定量关系,即内能与其他形式能量转换之间的定量关系 该定律表明,在任何热力学系统从一种状态转变为另一种状态的过程中,热力学第一定律有一个统一的数学表达式△U = q+w,由于研究的对象是系统,△U代表系统的内能增量,q代表系统吸收的热量,w代表环境对系统所做的功。 如果系统发热,q为负值;如果系统对环境产生积极作用,或者环境对系统产生消极作用(如气体膨胀等)。),w为负值
热力学第一定律的适用条件
热力学第一定律的适用条件热力学第一定律本质上等同于能量守恒定律。这是一个普遍的法律,适用于宏观和微观世界的所有系统和所有形式的能源。自1850年以来,科学界已经认识到能量守恒定律是自然界的普遍规律之一。能量的守恒和转化定律可以表达如下:自然界中的所有物质

热力学第一定律只适用于
热力学第一定律的适用条件范文
热力学第一定律第五模型:
主题:热力学第一定律的适用条件
基于本教程的指导性教学设计,讨论了热力学第一定律在开和闭和中的应用,讨论了热力学第一定律的适用条件与非准静态过程中体积功的定义和计算之间的关系。
关键词:热力学第一定律;辅导课;工作量;
文摘:讨论了热力学第一定律在开闭系统中的适用条件。此外,还研究了热力学第一定律的适用条件与非准静态过程体积功的定义和计算之间的关系。
关键词:热力学第一定律;辅导课程;工作量;
物理化学作为一门理论性和抽象性很强的化学课程,经常会让刚接触这门课程的学生感到不舒服。其中一个重要原因是他们需要有严格的逻辑思维习惯来掌握物理化学公式的适用条件。由于时间的原因,教师有时不能在课堂上充分讨论一些重要物理化学公式的适用条件。然而,如果教师能够利用辅导课的时间进行有针对性的指导和解释,就有可能取得更好的效果。热力学第一定律是热现象领域能量转换和守恒原理的一种特殊形式[1,2],其数学表达式为δU = Q+W,或D U =δQ+δW。对于该公式的适用条件,大多数物理化学教科书只提到对封闭系统的适用性,而没有系统讨论[3,4,5,6,7。在过去的教学过程中,我们还发现许多学生倾向于认为公式必须适用,只要它是一个封闭系统,但仔细分析可以发现,封闭系统只是公式适用的必要条件,而不是充分条件。系统讨论热力学第一定律数学表达式的适用条件,有助于学生深入理解热力学第一定律。它还能使刚开始接触物理化学的学生充分认识到准确理解物理化学公式适用条件的重要性。此外,这些讨论还可以帮助学生正确理解另一个容易混淆初学者的问题:非准静态过程中体积功的定义和计算。对于这一部分的教学,我们设计了一系列一致的、有针对性的问题,供学生在导师制课堂上思考和认真讨论,取得了良好的教学效果。

1非开放系统是热力学第一定律应用的必要条件
为了让学生更自然地理解非开放系统,这是应用热力学第一定律的前提,问题1是为学生设计的思考和讨论。
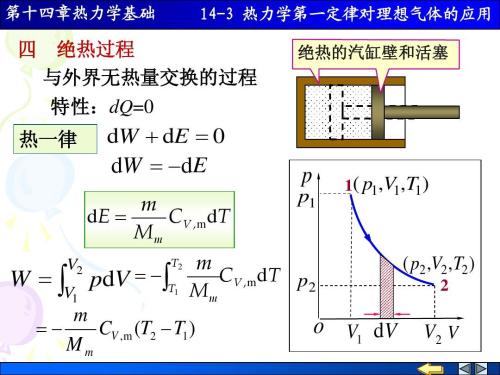
[问题1]请填写表1:
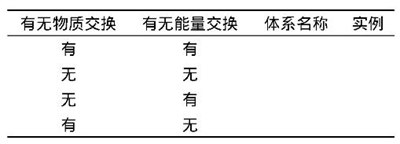
大多数学生可以快速完成前三种类型的系统空,即开放系统、隔离系统和封闭系统。然而,他们对第四类系统(有物质交换但没有能量交换)的存在感到困惑。教师可以指出,内能是物质的固有属性,当有物质交换时,能量交换是不可避免的。公式δU = Q+W只包括由功和热两种能量交换模式引起的系统内部能量变化,而不包括由物质交换引起的系统内部能量变化,因此公式δU = Q+W不适用于开放系统。
2封闭系统不是热力学第一定律应用的充分条件
通过对问题1的阐述,学生们已经理解了公式δU = Q+W不适用于开放系统,那么这个公式一定适用于封闭系统吗?有了这个问题,我们引入了问题2与学生讨论。
[问题2]如图1所示,木块甲放置在长木板乙上,而木板乙固定在地面上。一个连续的力目前被用来推动木块在木板上水平移动。以木块和木板为系统,先判断系统是否为封闭系统,然后讨论公式δU = Q+W是否适用于以下三种情况:
(1)木块和木板完全光滑;
(2)木块与木板之间的摩擦力等于F/2;
(3)木块与木板之间的摩擦力等于f。
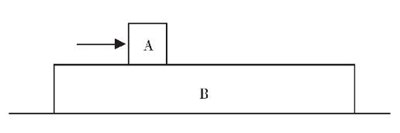
由于环境和系统之间只有能量交换,所以在这三种情况下系统都属于封闭系统,但是δU = Q+W对这三种情况的适用性是不同的。在第一种情况下,环境对系统确实起作用(W>0),但该作用完全转化为系统的总平面动能(木块a),而不是转化为系统的内能(δU = 0)。同时,该过程的热效应为0 (Q=0)。所以δU = Q+W不适用于第一种情况:δU 0,所以δU3热力学第一定律的适用条件和非准静态过程中体积功的定义和计算
在物理化学教科书中,体积功被定义为[3外的δW =-P。用这个公式计算准静态过程中的体积功不会给初学者造成理解问题,因为从计算的角度来看,系统压力和准静态过程中的环境压力是一致的。然而,对于非准静态过程中体积功的计算(系统的压力不同于环境的压力),学习者在理解这个公式[8,9,10时会有很大的困难。首先,这个公式表明膨胀和压缩过程的体积功应该由环境压力来计算,这与大多数人的机械直觉是直观相反的。其次,一个更严重的问题是,如果没有对这个公式的逻辑前提的深入理解,直接从δW =-P以外的d V进行计算确实会产生一些矛盾。
[问题3]如图2所示,一个无限刚性绝热容器被一个绝热无摩擦的活塞分成两部分,a和b。容器a中的理想气压为2p,容器b中的理想气压为p,当活塞在容器a中气体的作用下从a移动到b时,体积变化为δv,容器a中的气体对容器b中的气体做了多少功?
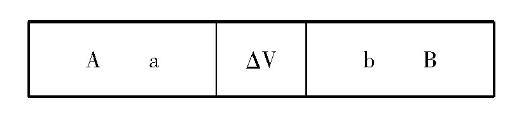
这个矛盾是,如问题3所示,将a和b分别作为相同过程的系统将导致完全不同的结果。因为两个容器a和b足够大,当活塞从a移动到b时,容器a中的气体体积增加δV,而容器b中的气体体积减少δV,但是因为容器是无限的,所以两侧的压力变化可以忽略。根据物理化学中体积功的定义,如果a被视为一个系统,外部压力为p,a至b的功值为pδv,如果b被视为一个系统,a至b的功值应为2pδv。
如何解决这个矛盾?乍一看,这个问题似乎与我们一直在讨论的热力学第一定律的适用性无关,但这两个问题实际上是密切相关的。这种联系是,这两个问题涉及内能和总平面动能之间的相互转换。根据牛顿力学,对问题3的分析表明,A的功值为2pδV,B的功值为pδV,二者之差(pδV)是活塞和气体分子的总平面动能。有关更详细的讨论,请参考“非准静态过程中体积功的定义和计算”[8。因此,根据牛顿力学的分析结果和直接根据体积功的定义进行的计算结果是不同的。显然,连接两者需要一些条件。
我们在前面的讨论中已经提到,如果系统在与环境交换能量的过程中引起非内能的变化,公式δU = Q+W可能不适用。在这个例子中,以b为系统,根据物理化学中体积功的定义,b获得的功值应该是W = 2pδV,但是b的实际内能增量应该小于2pδV,因为有些功(pδV)被转化为活塞和气体分子的总平面动能。因此,根据体积功的定义,δU = Q+W不适用于此过程。为了使体积功的定义δW =-p在d V之外,δU = Q+W同时适用,需要另一个逻辑前提或假设:非准静态过程中由内外压差引起的总平面动能最终将完全弛豫到系统的内能中。
根据上述逻辑前提再次分析问题3。根据牛顿力学,A做的功的值为2pδV,B做的功的值为pδV,两者之差(pδV)是活塞和气体分子的总平面动能。如果把一个系统视为一个系统,根据“非准静态过程中内外压差引起的总平面动能最终完全弛豫为系统的内能”的假设。如果活塞和气体分子的总平面动能(pδV)返回到a,a的外功是pδV,这与根据体积功定义的计算是一致的。如果将b视为一个系统,活塞和气体分子的总平面动能(pδV)按照同样的假设分配给b,则b获得的功为2pδV,这也与根据体积功定义的计算相一致。
这里需要解释的是,假设“非准静态过程中由内外压差引起的总平面动能最终将完全弛豫成系统的内能”,只是为了确保上述热力学系统可以是一个逻辑假设,而不是一个经验事实。当我们选择甲或乙作为系统时,现实世界如何真正将所有活塞和气体分子的总平面动能转化为甲或乙的内能?此外,这一假设并不是确保逻辑自给自足的唯一可行假设。学生可以自己证明,如果假设改为“非准静态过程中由内外压差引起的总水平动能最终完全弛豫为环境的内能”,体积功的定义修改为d V内的δW =-P,仍然可以保证逻辑自给自足。
通常在讲授热力学第一定律的这一部分时,由于时间和教学重点的原因,教师不要求学生掌握如何分析内能和总动能之间的相互转化。然而,如本文所示,如果教师能利用辅导课进行有针对性的指导和讲解,并在这方面适当培养学生的思维习惯,将有助于澄清一些重要而困惑的问题,增强学生的学习兴趣和信心。
参考
[1]昕薇,吴秦简,马晓东。热力学第一定律的叙述[。新疆师范大学学报:自然科学版,2011,23 (4) :59。
[2]姜亚龙。热力学第一定律教学探讨[。时代教育:教育与教学杂志,2011 (7) :6。
[3]傅蔡铣、沈夏雯、姚天阳。物理化学[。第五版。北京:高等教育出版社,2005。
[4]万弘文,詹郑坤。物理化学[。北京:高等教育出版社,2002。
[5]韩德刚、高志迪、高潘亮。物理化学[。北京:高等教育出版社。2002.
[6]朱志昂。现代物理化学[。北京:科学出版社,2004。
[7]尹永嘉,Xi郑恺,李大珍。[物理化学简明教程。第三版。北京:高等教育出版社,1992。
[8]董玉林,张联。非准静态过程中体积功的定义和计算[。武汉理工大学学报。2007年,29 (6) :140。
[9]李金玉、曾道刚、王鄢国。对不可逆过程体积功-膨胀功计算公式的讨论[。云南教育学院学报,1994,10 (5) :99。
[10]张学斌,张亚东。热力学体积功的计算[。大学物理,1995年。14 (6) :16。
范文1:热力学第一定律论文范文(6强推荐)
范文2:讲授热力学第一定律和热力学第二定律
范文3:热力学定律及其内涵分析
范文4:热力学第一定律在充气过程中的应用
范文5:热力学第一定律的适用条件


